下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| A |
|
|
|||||||||||||||
| b |
|
|
|
c |
d |
e |
f |
|
|||||||||
| g |
h |
i |
j |
|
k |
l |
m |
||||||||||
| n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 。
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)第三周期第一电离能介于铝和磷之间的第三周期元素有 种。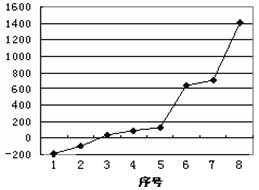
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:________________________。
(4)k l 2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体。
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题。
(1)元素D在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________。用电子式表示当C、D按1:1所组成化合物的形成过程________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
(5)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________。
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成气态化合物M的水溶液呈碱性,W的单质在X2中燃烧的产物可使品红溶液褪色,V是一种历史悠久,应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的一种化合物的一种用途 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。常温下该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。
(4)W(s)+O2(g) WO2(g); H1 W(g)+O2(g)
H1 W(g)+O2(g) WO2(g); H2
H2
则 Hl (填“>”或“<”或“=”)
Hl (填“>”或“<”或“=”) H2。
H2。
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
(6)若将V金属投入到硫酸溶液中,生成了浅绿色溶液N。写出N的溶液与K2Cr2O7酸性溶液反应的离子方程式: 。
在电冶铝的电解槽中存在电解质W3XZ6—XZ3—X2Y3,己知X、Y、Z、W四种元素的简单离子的电子层结构均相同。X原子最外层电子数等于电子层数,则下列说法正确的是
| A.原予序数:W>X>Y>Z |
| B.原子半径:r(W)>r(X)>r(Y)>r(Z) |
| C.最高价氧化物对应的水化物碱性:W<X |
| D.在电解过程中,W3XZ6的主要作用是增强电解质的导电性 |
甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为 (任写一个)。 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 ;利用该反应设计的燃料电池中,通入甲的电极为电池的 (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为 ;
②甲与水相比,热稳定性较强的是 (填化学式)。
下表是元素周期表短周期的一部分
| ① |
|
|
||||||
| |
|
|
|
② |
③ |
|
④ |
|
| |
⑤ |
⑥ |
⑦ |
|
|
|
|
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)④与⑤形成常见化合物的化学键的类型为 ,其电子式为 。
(3)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)。
(4)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
现有A、B、C、D四种元素,它们的质子数依次增多。①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;③C+离子比B3+离子多8个电子;④C与D元素可以形成化合物CD;⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C.D 的名称:C: ;D:
(2)A在周期表中的位置 。
(3)写出B2A3与氢氧化钠溶液反应的离子方程式 。
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):离子半径: 。
(1)原子序数11-17的元素,自钠到氯,电子层数相同,最外层电子数从 增加到 ,随着核电荷数依次递增,原子半径依次 ,核对外层电子的引力逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此,金属性逐渐 ,非金属性逐渐 。
(2)元素金属性的强弱,可以从它的单质与水或酸反应置换氢的 程度,以及它的最高价氧化物的水化物的 强弱来判断。元素非金属性的强弱,可以从它的最高价氧化物的水化物的 强弱,或它的单质跟H2生成气态氢化物的 及氢化物的 来判断。
(3)元素的性质随着原子序数的递增而呈 的变化,这个规律叫做元素周期律。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为 。请回答下列问题:
。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲+ H2O → 丙+ 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为 。
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
(5)写出B与D在高温下完全反应后生成物的电子式___ __ ,结构式___
(14分)W、X、Y、Z是元素周期表中前四周期的元素,它们的原子序数依次增加。请结合下表中的信息,回答下列问题
| W |
基态原子核外有三个能级,p能级电子处在半充满状态 |
| X |
是所有元素中电负性最大的元素 |
| Y |
气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z |
原子序数为22,被称为“未来金属” |
(1)Z位于元素周期表第_______族;该元素的基态原子价电子排布式为_____________。
(2)W与其同周期相邻的元素的第一电离能由大到小的顺序为________(填元素符号);X、Y两种元素与氢元素形成的共价键键能较大的是___________(请用元素符号表示)。
(3)X的气态氢化物的沸点在同族元素形成的气态氢化物中最_______(填“高”或“低”);已知WX3是微电子工业中优良的等离子刻蚀气体,沸点:129℃,其固态时的晶体类型为________,WX3在潮湿的空气中能与水蒸气发生氧化还原反应,反应生成的无色气体遇到空气变为红棕色,写出该反应的化学方程________。
(4)工业上制取Z的方法是:
第一步,在高温时,将金红石(ZO2)、炭粉混合并通人Y2制得ZY4和一种可燃性气体,已知(下列除Z、Y外其他都为实际元素符号)
①ZO2(s)+2Y(g)=ZY4(1)+O2(g) △H=-410.0kJ·mol-1
②CO(g)=C(s)+1/2O2(g) △H="+110.5" kJ·mol-1
则书写上述反应的热化学方程式是_________________________________________。
第二步,在氩气做保护气的环境中,用过量的金属镁在加热条件下与ZY4反应制得金属Z。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A与B同周期、A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E原子核外电子排布式是 。
(2)B的最高价含氧酸根的空间构型为 。
(3)A、B、D三种元素电负性由大到小排列顺序为 。
(4)D单质比化合物DA的熔点 (填“高”或“低”),理由是 。
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式 。
(本题15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
| 元素名称 |
氟 |
氧 |
溴 |
碘 |
铍 |
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2
 。
。 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
(6)写出一个ClO2-的等电子体:_________________。
有A、B、C、D四种元素,它们均为短周期元素。已知A是非金属性最强的元素,且D与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3 。
(1)写出A元素的离子结构示意图
(2)C、D两种元素形成化合物的电子式
(3)写出B投入硫酸铜溶液中发生反应的化学方程式
Ⅰ.① H与
H与 H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷 ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______(填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。
(1)D的化学式为__________________,A的二氯取代物有____________种。
(2)可作为植物生长调节剂的是________________________(填序号)。
短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A的原子结构示意图是___________ E的电子式为___________;
(2)D在周期表中的位置是 ______。它的下一周期同族元素最高价氧化物对应的水化物的分子式为___________;
(3)C与水反应的化学方程式是_________________________________,写出所得溶液中含有10个电子的微粒符号___________。