山西省太原市高三模拟考试(二)理综化学试卷
在电冶铝的电解槽中存在电解质W3XZ6—XZ3—X2Y3,己知X、Y、Z、W四种元素的简单离子的电子层结构均相同。X原子最外层电子数等于电子层数,则下列说法正确的是
| A.原予序数:W>X>Y>Z |
| B.原子半径:r(W)>r(X)>r(Y)>r(Z) |
| C.最高价氧化物对应的水化物碱性:W<X |
| D.在电解过程中,W3XZ6的主要作用是增强电解质的导电性 |
化学与社会、生活密切相关。下列说法正确的是
| A.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| B.大豆富含蛋白质,故豆浆煮沸后蛋白质变成了氨基酸 |
| C.石油的分馏、煤的气化、海水提溴的过程都包含化学变化 |
| D.地沟油经处理后可作为汽车燃油,故地沟油的成分是梭态烃 |
新型NaBH4—H2O2燃料电池(DBFC)的结构如图所示(已知.NaBH4中氢为-1价),有关该电池的说法不正确的是
A.放电过程中.Na+从A极区向B极区迁移
B.电极B材料中含MnO2层,MnO2起导电作用
C.在电池反应中,每消耗1 L 6 mol/LH2O2溶液,理论上流过电路中的电子为12 NA
D.电池负极区的电极反应为BH4—+8OH——8e—=BO2—+6H2O
25℃的四种溶液:①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH =12的NaOH溶液,有关上述溶液的说法,正确的是
| A.①、④溶液中水电离的c( H+):①>④ |
| B.将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ |
| C.分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② |
| D.将①、④溶液混合后pH =8,则c(Na+)—c(CH3COO—)=9.9×10—7mol/L |
分子式为C10H12O2的有机物,满足以下两个条件:①苯环上只有两个取代基;②能与NaHCO3溶液反应生成气体。则满足该条件的有机物共有(不考虑立体异构)
A.15种 B.12种 c.10种 D.9种
一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
25℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1L混合溶液,根据上表数据断,下列说法不正确的是
| A.在pH=5的溶液中.Fe3+不能大量存在 |
| B.混合溶液中c(SO42—):[c(Fe3+):c(Fe2+):c(Cu2+)]>5:4 |
| C.向混合溶液中逐滴加入0.1mol/LNaOH溶液,最先看到红褐色沉淀 |
| D.向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液 |
仅用下表提供的仪器和药品,就能达到相应实验目的的是
| 编号 |
仪器 |
药品 |
实验目的 |
| A |
托盘天平(带砝码)、胶头滴管、量筒、烧杯、约匙、玻璃棒 |
NaCl固体、蒸馏水 |
配制一定质量分数的NaCl溶液 |
| B |
分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 |
盐酸、大理石、碳酸钠溶液 |
证明非金属性:Cl>C>Si |
| C |
酸式滴定管、胶头滴管、铁架台(带铁圈) |
已知浓度的盐酸、待测NaOH溶液 |
测定NaOH溶液的物质的量浓度 |
| D |
烧杯、分液漏斗、胶头滴管、铁架台 |
待提纯的AlCl3溶液、NaOH溶液 |
提纯混有MgCl2杂质的AlCl3溶液 |
(14分)阿司匹林(又称乙酰水杨酸, 是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128—135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128—135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
制备基本操作流程、装置示意图和有关数据如下(夹持和加热仪器已略去):

| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
乙酸乙酯 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
易溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
可溶 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
可溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥仪器的原因是____。
(2)合成阿司匹林时,最合适的加热方法是____,其原因是________。抽滤所得粗产品要用少量冰水洗涤,其目的是________。
(3)上述所得粗产品中还有一些副产品,其中有一种是高分子化合物。提纯粗产品
①这种提纯方法叫做____。
②该方案中选用乙酸乙酯作溶剂的原因是____________________。
(4)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL乙酸酐(ρ=1.08g/cm-3),最终称得产品质量m=2.2 g,则所得乙酰水杨酸的产率为____(结果保留3位有效数字)。
(16分)为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
I.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=—574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=—867kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。电解的原理如图所示
则:写出该过程中产生NO的离子方程式:____________。
(3)电解时阴极的电极反应式为____;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。
Ⅲ利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数( )随时间(t)变化曲线如图。
)随时间(t)变化曲线如图。
回答:
(4)T1时,该反应的化学平衡常数的数值为____。
(5)下列说法不正确的是_______(填字母)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,在原容器中充入一定量氦气,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)△H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
CH3COOH(g)△H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
(6)①250—300℃时,乙酸的生成速率减小的主要原因是_______。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是_______。
用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下: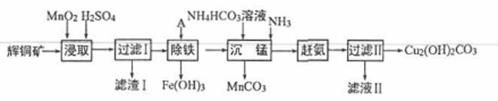
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
| A.延长浸取时间 | B.将辉铜矿粉碎 |
| C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
选考【化学——选修2化学与技术】(1 5分)将磷肥生产形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水台物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图: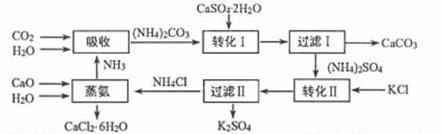
(1)本工艺中所用的原料除CaSO4·2H2O、CaCO3、H2O外,还需要的两种原料是____、____;写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:____。
(2)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的操作方法是________。
(3)过滤I的滤液中的Ca2+浓度低于1×10—5mol/L时可认为被沉淀完全。若要使Ca2+沉淀完全,则滤渡中c(CO32-)大于____。[已知:该温度下
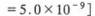
(4)写出“蒸氨”过程中的化学方程式:____。
(5)生产医用二水合氯化钙(CaCl2·2H2O )蒸发结晶要保持在160℃的原因是_______。氯化钙结晶水合物(CaCl2·6H2O )是目前常用的无机储热材料,选择的依据是______(填字母)。
a.熔点29℃较低 b.能导电 c.能制冷 d..无毒
选考【化学——选修3:物质结构与性质】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____(填“晶体”或“非晶体”)。
(2)基态铜原子的核外电子排布式为____;在CuSO4溶液中滴入过量氨水,形成配合物的颜色为____。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为________;卤素(SCN)2对应的酸有两种,理论推测硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是____。
(4)金属锌晶体的堆积方式为____。在ZnS晶胞中(结构如图1所示),S2-的配位数为____。
(5)铜有两种氧化物CuO、Cu2O,高温时易转化为Cu2O的原因为____(请从原子结构的角度解释)。
(6)铜与金形成的金属互化物结构如图2所示,其晶胞边长为apm,该金属互化物的密度为____g/cm3。(用含a、NA的代数式表示)
选考【化学——选修5:有机化学基础】 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林。某同学用对甲基苯酚为原料设计阿莫西林的合成路线如下:
是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林。某同学用对甲基苯酚为原料设计阿莫西林的合成路线如下:
(1)阿莫西林的分子式为____;反应②的试剂和条件为____。
(2)反应⑤的类型为____,写出D的结构筒式:____。
(3)写出反应④的化学方程式:________。
(4)说明反应①、⑦的目的:________。
(5)芳香族化合物G是E的同分异构体,且G分子满足下列条件:
i苯环上的一溴代物只有一种
ii核磁共振氢谱显示有4组峰
iii.能发生水解反应且产物之一的分子式为C7H8O3
写出符合上述条件的G的所有结构筒式:____________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号