新型NaBH4—H2O2燃料电池(DBFC)的结构如图所示(已知.NaBH4中氢为-1价),有关该电池的说法不正确的是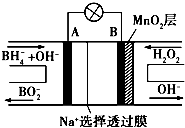
A.放电过程中.Na+从A极区向B极区迁移
B.电极B材料中含MnO2层,MnO2起导电作用
C.在电池反应中,每消耗1 L 6 mol/LH2O2溶液,理论上流过电路中的电子为12 NA
D.电池负极区的电极反应为BH4—+8OH——8e—=BO2—+6H2O
新型NaBH4—H2O2燃料电池(DBFC)的结构如图所示(已知.NaBH4中氢为-1价),有关该电池的说法不正确的是
A.放电过程中.Na+从A极区向B极区迁移
B.电极B材料中含MnO2层,MnO2起导电作用
C.在电池反应中,每消耗1 L 6 mol/LH2O2溶液,理论上流过电路中的电子为12 NA
D.电池负极区的电极反应为BH4—+8OH——8e—=BO2—+6H2O