化学为人类基本的生存需要、进而追求生活乃至生命质量的提升提供了重要的保障。但某些人的贪得无厌和对化学原理的滥用败坏了化学学科声誉,我们每个人都应该避免成为这样的人。下列科学史上的重要发现与发明,从原理上看与化学学科没有直接相关性的是
| A.1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒 |
| B.1869年门捷列夫发现元素周期律,使元素的性质更有规律可循 |
| C.1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量 |
| D.1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代 |
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
|
| |
Z |
W |
M |
请按要求回答下列问题:
(1)X元素名称 ,W的离子结构示意图 ;
(2)元素Z位于周期表中的位置是 ;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称 ;
(4)Y的最高价氧化物的化学式为____ _;M的最高价氧化物水化物名称为_______;
(5)Z、W、M三种元素中,原子半径最大的是 (填元素符号);这三者与氢元素形成的化合物中,最稳定的是 (填:氢化物的化学式),它的电子式为 ;
(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是 (填:“离子键”或“共价键”)。
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化。则在该条件下A 完全转化为B(填:“能”或“不能”)
0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
| A.第三周期第IA族 | B.第四周期第IA族 |
| C.第三周期第ⅡA族 | D.第四周期第ⅡA族 |
(10分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D元素与B元素的质量比为7:8;E元素与B元素的质量比为1:1。试回答:
(1)写出D原子的电子排布式____________________。
(2)用电子式表示AE2的形成过程________________________________________。
(3)B、C两元素的第一电离能较大的元素是:________(填写元素符号)。
(4)C的氢化物的VSEPR模型为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为:________>________(填写化学式)。
(6)由元素D组成的单质晶体中,与某个D原子距离最近的D原子有_____个;1molD的氧化物晶体中,含D-O键的数目____________。
(14分)今有aX、bY、cZ三种元素。
已知:
①各原子序数a、b、c均小于20,且a+b+c=25;
②元素Y的原子外围电子构型为ns2npn+2;
③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;
④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38:77。
据上可推知,
(1)X、Y、Z三种元素形成的常见化合物的化学式是_________________。
(2)X2Y2是________晶体(填晶体类型),构成晶体的微粒是________(填微粒符号) ,该晶体中微粒间的作用有__________________________________。
(3)Z的硫化物和氯化物的分子空间构型分别是____________、__________,其中Z原子分别以______杂化轨道成键,根据成键方式分类,Z的硫化物分子中含有的键的种类及其数目是______________。
(4)Z的氢化物种类很多,写出Z的氢化物分子中所有原子都在同一平面上的任意两种简单的化合物的名称_________、__________。
(11分)下图是元素周期表的一部分
(1)写出元素⑩的基态原子的电子排布简化式________,外围电子排布图________________。指出它在周期表中的位置________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一条反应的化学方程式_____________________________。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式________,推测该分子的空间构型为________。
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中熔点最高的是________(写化合物的化学式)。如果在温度接近373 K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果总是比理论值高,其原因是___________________________________________。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式___________________________。
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76 g·L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应。下列说法不正确的是
A.M的单质可用于从钛、锆等金属的氯化物中置换出钛、锆等单质
B.由X、Y、Z三种元素形成的某种化合物的水溶液,可能呈碱性或酸性
C.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
D.含有W阳离子的某种盐,可用作净水剂
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
| A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D.Z的氢化物比X的氢化物更稳定 |
已知钍( )的原子可发生下列放射性变化,
)的原子可发生下列放射性变化, ,生成的X是与钫(Fr)同周期的一种元素的原子,下列对X的推断错误的是
,生成的X是与钫(Fr)同周期的一种元素的原子,下列对X的推断错误的是
| A.X的氢氧化物是一种强碱 |
| B.X的碳酸正盐不溶于水 |
| C.X原子核外有6个电子层 |
| D.X的最高化合价为+2价 |
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R2-所含有电子的物质的量是
A. mol mol |
B. mol mol |
C. mol mol |
D. mol mol |
A、B、C、D是原子序数依次增大的同一短同期元素,A、B是金属元素,C、D是非金属元素。
(1)A、B各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____________________。
(2)A与C 可形成化合物A2C,该化合物的电子式为______________。
(3)C的低价氧化物通入D单质的水溶液中,发生反应的化学方程式为_______________。
(4)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):
_____>_____>______>______。
(5)四种元素中金属性最强的(填元素符号)______;非金属性最强的__________
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。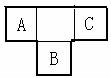
(1)B元素位于元素周期表中第 周期,第 族。
(2)由元素C与Mg元素形成的化合物的化学键的类型 。
(3)由元素A与氢元素形成的化合物的结构式 。
(4)由元素B与氢元素形成的化合物的电子式 。
(5)写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式: 。
(9分)学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系。已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物。
(1)假设A、D元素处于同主族:
①当B是H2O时,化学方程式 ;
②当B、C均为氧化物时,化学方程式 ,其工业价值是 。
(2)假设A、 D不在同主族:
①当B是H2O且B是还原剂时,化学方程式 。
②当B是H2O且B是氧化剂时,化学方程式 。
下列各组原子中,彼此化学性质一定相似的是
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |