年辽宁实验分校高二下6月阶段测试化学试卷
在离子 RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
| A.A-X+n+48 | B.A-X+n+24 |
| C.A-X-n-24 | D.A+X-n-24 |
以下电子排布式表示基态原子电子排布的是
| A.1s22s22p63s13p3 | B.1s22s22p63s23p63d104s14p1 |
| C.1s22s22p63s23p63d24s1 | D.1s22s22p63s23p63d104s24p1 |
下列基态原子的核外电子排布违背洪特规则的是
| A.C:1s22s12p3 | B.N:1s22s32p2 |
| C.O:1s22s22px22py2 | D.Cu:[Ar]3d94s2 |
下列各组表述中,两个粒子一定不属于同种元素原子的是
| A.3p能级有一个空轨道的基态原子和核外电子排布为 1s22s22p63s23p2的原子 |
| B.M层全充满而N层为4s2的原子和核外电子排布式为 1s22s22p63s23p63d64s2的原子 |
| C.最外层电子数是核外电子总数的1/5原子和价电子排布为 4s24p5的原子 |
| D.2p能级有一个未成对电子的基态原子和原子的价电子排布为 2s22p5的原子 |
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1).
| |
I1 |
I2 |
I3[来源:] |
I4 |
…… |
| R |
740 |
1500 |
7700 |
10500 |
…… |
下列关于元素R的判断中一定正确是
A.R的最高正价为+3价
B.R元素位于元素周期表中第ⅡA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为1s22s2
下列对一些实验事实的理论解释正确的是
| 选项 |
实 验 事 实 |
理 论 解 释 |
| A. |
SO2溶于水形成的溶液能导电 |
SO2是电解质 |
| B. |
白磷为正四面体分子 |
白磷分子中P—P间的键角是109°28′ |
| C. |
1体积水可以溶解700体积氨气 |
氨是极性分子且由于有氢键的影响 |
| D. |
HF的沸点高于HCl |
H—F的键长比H—Cl的键长短 |
类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是
| A.第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| B.SiO2晶体熔化时破坏的是共价键;所以CO2晶体熔化时破坏的也是共价键 |
| C.可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝 |
| D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
下列说法正确的是
| A.氯化钠和盐酸溶于水都发生电离,克服粒子问作用力的类型相同 |
| B.金刚石的网状结构中,由共价键形成的最小碳环上有12个碳原子 |
| C.HI的分子质量大于HF,所以HI的沸点高于HF |
| D.由IA族和VIA族元素形成的原子个数比为1:1,粒子个数比为2:l的化合物是含有共价键的离子化合物 |
下列叙述正确的是
| A.NH3是极性分子,N原子处在3个H原子所组成的三角形的中心 |
| B.CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心 |
| C.H2O是极性分子,O原子不处在2个H原子所连成的直线的中央 |
| D.CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央 |
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用力依次是
| A.氢键;分子间作用力;非极性键 | B.氢键;氢键;极性键 |
| C.氢键;极性键;分子间作用力 | D.分子间作用力;氢键;极性键 |
下列对分子的性质的解释中,不正确的是
| A.水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关 |
| B.[Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物 |
| C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| D.由下图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |

下列说法正确的是
| A.冰、水和水蒸气中都存在氢键 |
| B.除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| C.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11 |
| D.干冰升华时分子内共价键会发生断裂 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化 |
| B.NH3中N原子形成三个杂化轨道,CH4中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.NH3分子中有三个σ键,而甲烷分子中有四个σ键 |
在乙烯分子中有5个σ键、一个π键,它们分别是
| A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |
下列有关杂化轨道的说法不正确的是
| A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道 |
| B.轨道数目杂化前后可以相等,也可以不等 |
| C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原理 |
| D.杂化轨道可分为等性杂化轨道和不等性杂化轨道 |
石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面网状结构,如果将每对相邻碳原子间的短线看成一个化学键,则石墨晶体中每一层内碳原子数与C—C键数的比是
| A.2∶3 | B.1∶3 | C.1∶1 | D.1∶2 |
SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为
| A.6种 | B.7种 | C.10种 | D.12种 |
已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期。NH3分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的构型关系是________(填“相同”或“相似”或“不相似”),P—H______极性(填“有”或“无”),PH3分子________极性(填“有”或“无”)。
(2)NH3与PH3相比,热稳定性________更强(填化学式)。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________.
| A.键的极性N—H比P—H强 |
| B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 |
| D.NH3分子之间存在特殊的分子间作用力 |
(4)笑气(N2O)是一种麻醉剂,有关理论认为N2O与CO2分子具有相似的结构(包括电子式)。已知N2O分子中氮原子只与氧原子相连,N2O的电子式为____,其空间构型是____,由此可知它是____(填“极性”或“非极性”)分子。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| A |
|
|
|||||||||||||||
| b |
|
|
|
c |
d |
e |
f |
|
|||||||||
| g |
h |
i |
j |
|
k |
l |
m |
||||||||||
| n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 。
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)第三周期第一电离能介于铝和磷之间的第三周期元素有 种。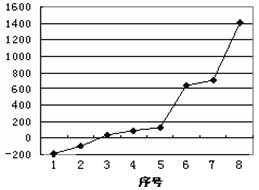
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:________________________。
(4)k l 2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体。
判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示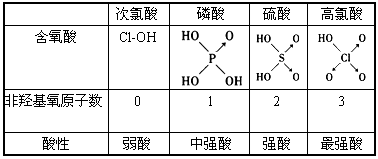
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构式分别为 、
、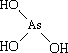 。
。
简述二者酸性强弱原因_____________________。
(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:
①___________________; ②_______________________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号