[化学—选修3:物质结构与性质]
ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_____,在与其他元素形成化合物时,呈现的最高化合价为_____。
(2) 俗称电石,该化合物中不存在的化学键类型为_____(填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷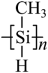 ,其中电负性最大的元素是_____,硅原子的杂化轨道类型为_____。
,其中电负性最大的元素是_____,硅原子的杂化轨道类型为_____。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_____。

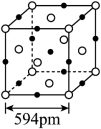
(5)结晶型 可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为_____。设 为阿伏加德罗常数的值,则该晶体密度为_____ (列出计算式)。
甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯 的研究所获得的部分数据如下。回答下列问题:
(1)已知如下热化学方程式:
计算反应 的 _____ 。
(2) 与 反应生成 ,部分 会进一步溴化。将 和 。通入密闭容器,平衡时, 、 与温度的关系见下图(假设反应后的含碳物质只有 、 和 )。
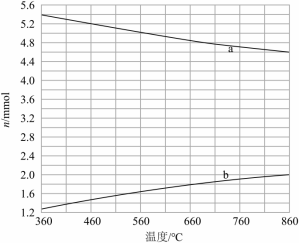
(i)图中 的曲线是_____(填“a”或“b”)。
(ii) 时, 的转化 _____, _____ 。
(iii) 时,反应 的平衡常数 _____。
(3)少量 可提高生成 的选择性。 时,分别在有 和无 的条件下,将 和 ,通入密闭容器,溴代甲烷的物质的量(n)随时间(t)的变化关系见下图。
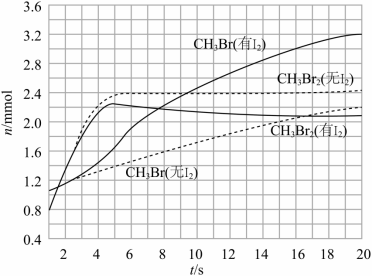
(i)在 之间,有 和无 时 的生成速率之比 _____。
(ii)从图中找出 提高了 选择性的证据:_____。
(ⅲ)研究表明, 参与反应的可能机理如下:
①
②
③
④
⑤
⑥
根据上述机理,分析 提高 选择性的原因:_____。
(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:
(一)过氧化脲的合成
烧杯中分别加入 、 蒸馏水和 尿素,搅拌溶解。 下反应 ,冷却结晶、过滤、干燥,得白色针状晶体 。
(二)过氧化脲性质检测
I.过氧化脲溶液用稀 酸化后,滴加 溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀 酸化后,加入 溶液和四氯化碳,振荡,静置。
(三)产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成 溶液。
滴定分析:量取 过氧化脲溶液至锥形瓶中,加入一定量稀 ,用准确浓度的 溶液滴定至微红色,记录滴定体积,计算纯度。
回答下列问题:
(1)过滤中使用到的玻璃仪器有_____(写出两种即可)。
(2)过氧化脲的产率为_____。
(3)性质检测Ⅱ中的现象为_____。性质检则I和Ⅱ分别说明过氧化脲具有的性质是_____。
(4)下图为“溶液配制”的部分过程,操作a应重复3次,目的是_____,定容后还需要的操作为_____。
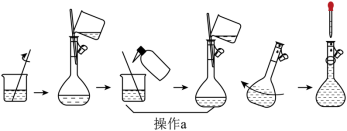
(5)“滴定分析”步骤中,下列操作错误的是_____(填标号)。
| A. |
溶液置于酸式滴定管中 |
| B. |
用量筒量取 过氧化脲溶液 |
| C. |
滴定近终点时,用洗瓶冲洗锥形瓶内壁 |
| D. |
锥形瓶内溶液变色后,立即记录滴定管液面刻度 |
(6)以下操作导致氧化脲纯度测定结果偏低的是_____(填标号)。
| A. |
容量瓶中液面超过刻度线 |
| B. |
滴定管水洗后未用 溶液润洗 |
| C. |
摇动锥形瓶时 溶液滴到锥形瓶外 |
| D. |
滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
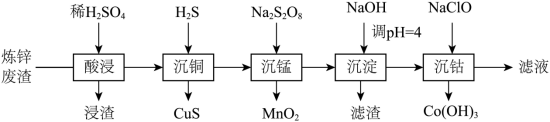
注:加沉淀剂使一种金属离子浓度小于等于 ,其他金属离子不沉淀,即认为完全分离。
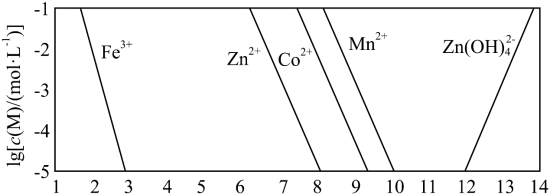
已知:① 。
②以氢氧化物形式沉淀时, 和溶液 的关系如图所示。
回答下列问题:
(1)“酸浸”前,需将废渣磨碎,其目的是_____。
(2)“酸浸”步骤中, 发生反应的化学方程式是_____。
(3)假设“沉铜”后得到的滤液中 和 均为 ,向其中加入 至 沉淀完全,此时溶液中 =_____ ,据此判断能否实现 和 的完全分离_____(填“能”或“不能”)。
(4)“沉锰”步骤中,生成 ,产生 的物质的量为_____。
(5)“沉淀”步骤中,用 调 ,分离出的滤渣是_____。
(6)“沉钴”步骤中,控制溶液 ,加入适量的 氧化 ,其反应的离子方程式为_____。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____。
将 配制成 悬浊液,向其中滴加 的 溶液。 ( 代表 、 或 )随加入 溶液体积( )的变化关系如图所示。
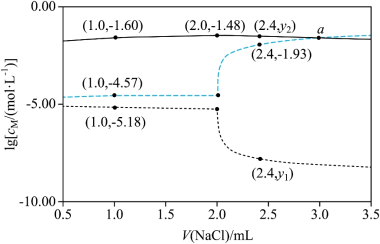
下列叙述正确的是( )
| A. |
交点a处: |
| B. |
|
| C. |
时, 不变 |
| D. |
, |
科学家使用 研制了一种 可充电电池(如图所示)。电池工作一段时间后, 电极上检测到 和少量 。下列叙述正确的是( )
| A. |
充电时, 向阳极方向迁移 |
| B. |
充电时,会发生反应 |
| C. |
放电时,正极反应有 |
| D. |
放电时, 电极质量减少 , 电极生成了 |
W、X、Y、Z为原子序数依次增大的短周期元素。W和X原子序数之和等于 的核外电子数,化合物 可用作化学电源的电解质。下列叙述正确的是( )
| A. |
X和Z属于同一主族 |
| B. |
非属性: |
| C. |
气态氢化物的稳定性: |
| D. |
原子半径: |
四瓶无色溶液 、 、 、 ,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是( )
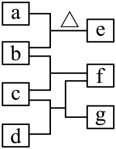
| A. |
a呈弱碱性 |
| B. |
f可溶于过量的b中 |
| C. |
c中通入过量的e可得到无色溶液 |
| D. |
b和d反应生成的沉淀不溶于稀硝酸 |
我国化学工作者开发了一种回收利用聚乳酸( )高分子材料的方法,其转化路线如下所示。
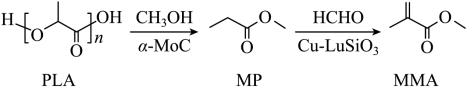
下列叙述错误的是( )
| A. |
在碱性条件下可发生降解反应 |
| B. |
的化学名称是丙酸甲酯 |
| C. |
的同分异构体中含羧基的有 种 |
| D. |
可加聚生成高分子 |
下列过程对应的离子方程式正确的是( )
| A. |
用氢氟酸刻蚀玻璃: |
| B. |
用三氯化铁溶液刻制覆铜电路板: |
| C. |
用硫代硫酸钠溶液脱氯: |
| D. |
用碳酸钠溶液浸泡锅炉水垢中的硫酸钙: |
人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。下列有关能源的叙述错误的是( )
| A. |
木材与煤均含有碳元素 |
B. |
石油裂化可生产汽油 |
| C. |
燃料电池将热能转化为电能 |
D. |
太阳能光解水可制氢 |
实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
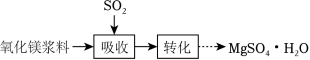
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成 ,反应为 ,其平衡常数 与 的代数关系式为 __________;下列实验操作一定能提高氧化镁浆料吸收 效率的有_____(填序号)。
| A. |
水浴加热氧化镁浆料 |
| B. |
加快搅拌速率 |
| C. |
降低通入 气体的速率 |
| D. |
通过多孔球泡向氧化镁浆料中通 |
(2)在催化剂作用下 被 氧化为 。已知 的溶解度为 , 氧化溶液中 的离子方程式为__________;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 被 氧化的速率随 的变化如题图甲所示。在 范围内,pH增大,浆料中 的氧化速率增大,其主要原因是__________。
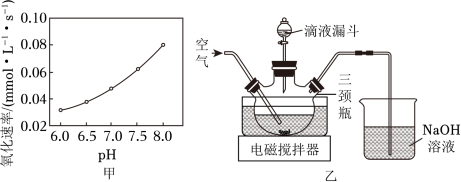
(3)制取 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与 溶液充分反应。 浆料与 溶液的加料方式是__________;补充完整制取 晶体的实验方案:向含有少量 的 溶液中,_______________。(已知: 在 时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出 , 在 下干燥得到 ,实验中需要使用 粉末)
化合物 是鞘氨醇激酶抑制剂,其合成路线如图:
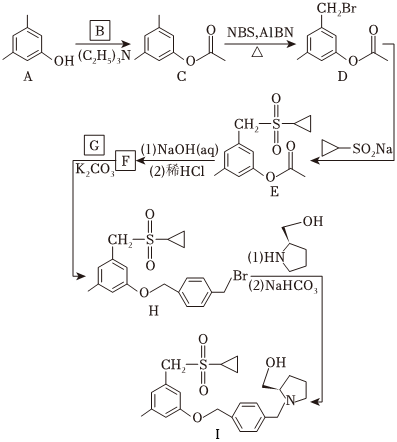
(1)化合物A的酸性比环己醇的_____(填“强”或“弱”或“无差别”)。
(2)B的分子式为 ,可由乙酸与 反应合成,B的结构简式为_____。
(3)A→C中加入 是为了结构反应中产生的_____(填化学式)。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:_____。碱性条件水解后酸化生成两种产物,产物之一的分子中碳原子轨道杂化类型相同且室温下不能使 酸性 溶液褪色;加热条件下,铜催化另一产物与氧气反应,所得有机产物的核磁共振氢谱中只有 个峰。
(5)G的分子式为 ,F→H的反应类型为_____。
(6)写出以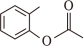 、
、 和
为原料制备
和
为原料制备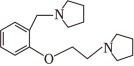 的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
催化剂能催化 脱除烟气中的 ,反应为 。
(1)催化剂的制备。将预先制备的一定量的 粉末置于 的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中 水解为 沉淀的离子方程式为__________;反应选用 溶液而不选用 溶液的原因是__________。
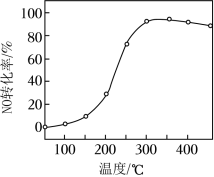
(2)催化剂的应用。将一定物质的量浓度的 (其余为 )气体匀速通过装有 催化剂的反应器,测得 的转化率随温度的变化如题图所示。反应温度在 范围内, 转化率随温度变化不明显的原因是__________;反应温度高于 , 转化率下降,除因为进入反应器的 被还原的量减少外,还有__________(用化学方程式表示)。
(3)废催化剂的回收。回收 废催化剂并制备 的过程可表示为
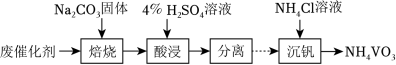
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有__________。
②通过萃取可分离钒和钨,在得到的钒酸中含有 。已知 具有八元环结构,其结构式可表示为__________。
③向 的 溶液中加入过量的 溶液,生成 沉淀。已知: ,加过量 溶液的目的是__________。