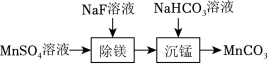
室温下,用含少量 的MnSO4溶液制备 的过程如题图所示。已知 , 。下列说法正确的是( )
| A. |
溶液中: |
| B. |
“除镁”得到的上层清液中: |
| C. |
溶液中: |
| D. |
“沉锰”后的滤液中: |
室温下,探究 溶液的性质,下列实验方案能达到探究目的的是( )
|
选项 |
探究目的 |
实验方案 |
|
A |
溶液中是否含有 |
向 溶液中滴加几滴新制氯水,再滴加 溶液,观察溶液颜色变化 |
|
B |
是否有还原性 |
向 溶液中滴加几滴酸性 溶液,观察溶液颜色变化 |
|
C |
是否水解 |
向 溶液中滴加 滴酚酞试液,观察溶液颜色变化 |
|
D |
能否催化 分解 |
向 溶液中滴加几滴 溶液,观察气泡产生情况 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
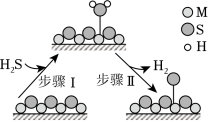
金属硫化物( )催化反应 ,既可以除去天然气中的 ,又可以获得 。下列说法正确的是( )
| A. |
该反应的 |
| B. |
该反应的平衡常数 |
| C. |
题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的 与催化剂中的 之间发生作用 |
| D. |
该反应中每消耗 ,转移电子的数目约为 |
化合物 是合成药物非奈利酮的重要中间体,其合成路线如图:

下列说法正确的是( )
| A. |
不能与 溶液发生显色反应 |
| B. |
中的含氧官能团分别是酯基、羧基 |
| C. |
最多能与 发生加成反应 |
| D. |
可用饱和 溶液和 银氨溶液进行鉴别 |
氮及其化合物的转化具有重要应用。下列说法不正确的是( )
| A. |
实验室探究稀硝酸与铜反应的气态产物:
(稀) |
| B. |
工业制硝酸过程中的物质转化:
|
| C. |
汽车尾气催化转化器中发生的主要反应:
|
| D. |
实验室制备少量
的原理:
|
阅读下列材料,完成下面小题。
氢元素及其化合物在自然界广泛存在且具有重要应用。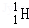 、
、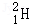 、
、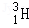 是氢元素的3种核素,基态
原子
的核外电子排布,使得
既可以形成
又可以形成
,还能形成
等重要化合物;水煤气法、电解水、光催化分解水都能获得
,如水煤气法制氢反应中,
与足量
反应生成
和
吸收
的热量。
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在催化剂作用下与
反应可得到
。我国科学家在氢气的制备和应用等方面都取得了重大成果。
是氢元素的3种核素,基态
原子
的核外电子排布,使得
既可以形成
又可以形成
,还能形成
等重要化合物;水煤气法、电解水、光催化分解水都能获得
,如水煤气法制氢反应中,
与足量
反应生成
和
吸收
的热量。
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在催化剂作用下与
反应可得到
。我国科学家在氢气的制备和应用等方面都取得了重大成果。
(1)下列说法正确的是( )
| A. |
|
| B. |
和 的中心原子轨道杂化类型均为 |
| C. |
分子中的化学键均为极性共价键 |
| D. |
晶体中存在 与 之间的强烈相互作用 |
(2)下列化学反应表示正确的是( )
| A. |
水煤气法制氢: |
| B. |
催化加氢生成
的反应:
|
| C. |
电解水制氢的阳极反应: |
| D. |
与水反应: |
(3)下列物质结构与性质或物质性质与用途具有对应关系的是( )
| A. |
具有还原性,可作为氢氧燃料电池的燃料 |
| B. |
氨极易溶于水,液氨可用作制冷剂 |
| C. |
分子之间形成氢键, 的热稳定性比 的高 |
| D. |
中的 原子与 形成配位键, 具有还原性 |
元素 位于周期表中 族。下列说法正确的是( )
| A. |
原子半径: |
| B. |
第一电离能: |
| C. |
碳单质、晶体硅、 均为共价晶体 |
| D. |
可在周期表中元素 附近寻找新半导体材料 |
实验室制取 的实验原理及装置均正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
反应 应用于石油开采。下列说法正确的是( )
| A. |
的电子式为 |
| B. |
中N元素的化合价为 |
| C. |
分子中存在 键 |
| D. |
为非极性分子 |
我国提出2060年实现碳中和的目标,体现了大国担当。碳中和中的碳是指( )
| A. |
碳原子 |
B. |
二氧化碳 |
C. |
碳元素 |
D. |
含碳物质 |
超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如图:

知:①金属 的化学性质和 相似, 的熔点为 ;
② (乙醚)和 (三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
|
|
|
|
回答下列问题:
(1)晶体 的晶体类型是_____;
(2)“电解精炼”装置如图所示,电解池温度控制在 的原因是__________,阴极的电极反应式为_____;

(3)“合成 ”工序中的产物还包括 和 ,写出该反应的化学方程式_______________;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_____;
(5)下列说法错误的是_____;
A.流程中 得到了循环利用
B.流程中,“合成 ”至“工序 ”需在无水无氧的条件下进行
C.“工序 ”的作用是解配 ,并蒸出
D.用核磁共振氢谱不能区分 和
(6)直接分解 不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯 的理由是 ____________________;
(7)比较分子中的 键角大小: _____ (填“>”“<”或“=”),其原因是__________。
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
②
③
计算反应④ _____ ;
(2)在某温度、 下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为 ,欲将平衡转化率提高至 ,需要向反应器中充入_____ 水蒸气作为稀释气(计算时忽略副反应);
(3)在 下,以水蒸气作稀释气、 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤
⑥
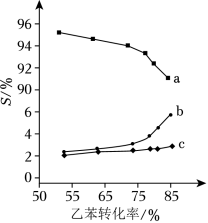
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性 ( )随乙苯转化率的变化曲线如图所示,其中曲线 代表的产物是_____,理由是__________;
(4)关于本反应体系中催化剂 的描述错误的是_____;
| A. |
射线衍射技术可测定 晶体结构 |
| B. |
可改变乙苯平衡转化率 |
| C. |
降低了乙苯脱氢反应的活化能 |
| D. |
改变 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进 (引发剂, 表示卤素)生成自由基 ,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是_____;
(6)室温下,① 在配体 的水溶液中形成 ,其反应平衡常数为 ;
② 在水中的溶度积常数为 。由此可知, 在配体 的水溶液中溶解反应的平衡常数为_____(所有方程式中计量系数关系均为最简整数比)。
金属 对 有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氧化反应。将块状Ni转化成多孔型雷尼 后,其催化活性显著提高。
已知:①雷尼 暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼Ni并探究其催化氢化性能的实验如下:
步骤1:雷尼 的制备
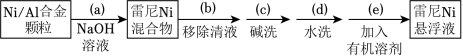
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如图(夹持装置和搅拌装置略),装置Ⅰ用于储存 和监测反应过程。

回答下列问题:
(1)操作(a)中,反应的离子方程式是__________;
(2)操作(d)中,判断雷尼 被水洗净的方法是__________;
(3)操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是_____;
| A. |
丙酮 |
| B. |
四氯化碳 |
| C. |
乙醇 |
| D. |
正己烷 |
(4)向集气管中充入 时,三通阀的孔路位置如图所示;发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为_____;

(5)仪器M的名称是:_____;
(6)反应前应向装置Ⅱ中通入 一段时间,目的是__________;
(7)如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是__________;
(8)判断氢化反应完全的现象是__________。
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 (Ⅱ)催化剂{用 表示}能高效电催化氧化 合成 ,其反应机理如图所示。下列说法错误的是( )
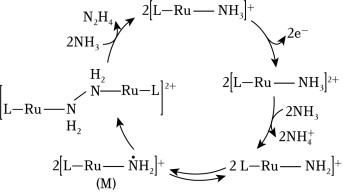
| A. |
(Ⅱ)被氧化至 (Ⅲ)后,配体 失去质子能力增强 |
| B. |
中 的化合价为 |
| C. |
该过程有非极性键的形成 |
| D. |
该过程的总反应式: |