金属硫化物( )催化反应 ,既可以除去天然气中的 ,又可以获得 。下列说法正确的是( )
| A. |
该反应的 |
| B. |
该反应的平衡常数 |
| C. |
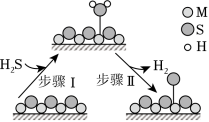
题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的 与催化剂中的 之间发生作用 |
| D. |
该反应中每消耗 ,转移电子的数目约为 |
金属硫化物( )催化反应 ,既可以除去天然气中的 ,又可以获得 。下列说法正确的是( )

| A. |
该反应的 |
| B. |
该反应的平衡常数 |
| C. |
题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的 与催化剂中的 之间发生作用 |
| D. |
该反应中每消耗 ,转移电子的数目约为 |