实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
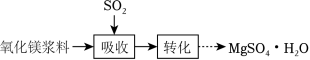
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成 ,反应为 ,其平衡常数 与 的代数关系式为 __________;下列实验操作一定能提高氧化镁浆料吸收 效率的有_____(填序号)。
| A. |
水浴加热氧化镁浆料 |
| B. |
加快搅拌速率 |
| C. |
降低通入 气体的速率 |
| D. |
通过多孔球泡向氧化镁浆料中通 |
(2)在催化剂作用下 被 氧化为 。已知 的溶解度为 , 氧化溶液中 的离子方程式为__________;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 被 氧化的速率随 的变化如题图甲所示。在 范围内,pH增大,浆料中 的氧化速率增大,其主要原因是__________。
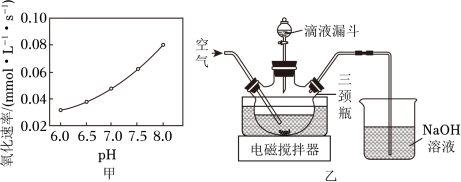
(3)制取 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与 溶液充分反应。 浆料与 溶液的加料方式是__________;补充完整制取 晶体的实验方案:向含有少量 的 溶液中,_______________。(已知: 在 时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出 , 在 下干燥得到 ,实验中需要使用 粉末)

 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O




 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)  粤公网安备 44130202000953号
粤公网安备 44130202000953号