探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy + y H2 x Fe + y H2O,Fe3C + 2 H2
x Fe + y H2O,Fe3C + 2 H2 3 Fe + CH4。
3 Fe + CH4。
(1)写出焙烧中氧化铁与CO反应的化学方程式: 。
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 。
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知3 CH4 + 4 Fe2O3 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A处、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量。
操作的先后顺序是①→③→ →⑤→⑥→⑦(填字母)
A.②→④ B.④→②
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;
(5)若缺少装置D,则所测氧元素的质量分数将 (填“偏大’’“偏小"或“不变")。
(6)粗还原铁粉样品的质量为20.000 g,装置B、E分别增重0.360 g和0.440 g,则计算样品出中碳元素的质量分数是 ,氧元素的质量分数是 。
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验。试回答:
【查阅资料】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解生成CO2和CO。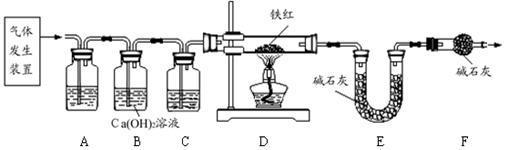
(1)实验前应先 。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是 、C中的试剂是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是 。
(4)某同学认为图示装置有不足之处,改进的方法是 。
现要制取一些二氧化氮气体来做演示分子运动的实验。
已知二氧化氮气体可以通过铜和浓硝酸反应:
Cu+4HN03(浓)=Cu(NO3)2+2N02↑+2H2O得到。 二氧化氮是一种红棕色的气体,密度比空气大,能和水反应生成HNO3和NO气体,NO和NO2都是大气污染物,NO2能与碱溶液反应。现给出下列装置(A—F):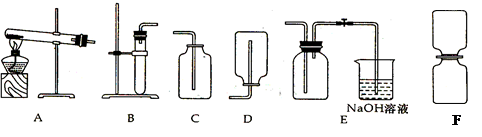
(1)制二氧化氮的发生装置可以选 ,收集二氧化氮的装置最好选 。
(2)写出二氧化氮和水反应的化学方程式 。
(3)要得到干燥的二氧化氮可将其通过 。(填物质名称)
(4)NO一遇到O2就会变成NO2,收集NO应用 法。
(5)用如上图F装置演示分子运动时,为了缩短演示的时间,NO2最好放在 面的集气瓶中,另一瓶是空气,抽去两瓶之间的玻璃片,可以看到 。
(6)小林同学用装置BC组合制取了一瓶无色无味纯净的气体,他制取的气体可能是_____;
试用最简单的方法验证他制取的气体___________________。
为测定某纯碱样品(含少量氯化钠杂质,不与稀盐酸反应)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6 g(产生的气体全部逸出)。试计算:
(1)反应生成二氧化碳的质量为 g。
(2)稀盐酸中溶质的质量分数(写出计算过程)。
甲醇(CH3OH)是一种有毒、有酒精气味可燃性液体。甲醇在氧气中完全燃烧反应表示为:2 CH3OH+nO2=mCO2+pH2O(其中n、m、p表示化学计量数),若反应生成3.6g水。试计算:
(1)m值是 ;
(2)参加反应的氧气的质量是多少克?(请写出规范的计算步骤)
某实验探究小组的同学设计了下图装置测定水中氢、氧元素的质量比,请你与他们一起探究
(1)写出图中a仪器的名称 使用该仪器的一点注意事项 ;
(2)其中A装置中发生反应的化学方程式为 ,该装置还可以用于实验室制取 气体(写出一种即可)。
(3)实验时,应先通一段时间的H2,再加热氧化铜,目的是 。
(4)测得C装置的玻璃管中样品在实验前后减少了1.6g,D装置增加了1.85g,按实验结果计算出水中H、O元素的质量比为 (化为整数比);同学们反复操作后得出的结果还是不变,若装置的气密性及所有的操作是正确的,结果异常的原因是 ,
某K2CO3样品,一定含Na2CO3、KNO3和Ba(NO3)2杂质中的一种或两种,将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀,对样品所含杂质的正确判断是
| A.肯定有KNO3 | B.肯定有KNO3,还可能有Na2CO3 |
| C.一定没有Ba(NO3)2,可能有KNO3 | D.肯定没有Na2CO3和Ba(NO3)2 |
除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
| 选项 |
待提纯的物质 |
选用的试剂 |
操作方法 |
| A |
NaOH(Na2CO3) |
氯化钙溶液 |
溶解、过滤、蒸发、结晶 |
| B |
CO2(CO) |
氧气 |
点燃 |
| C |
Cu(CuO) |
稀盐酸 |
溶解、过滤、洗涤、干燥 |
| D |
CuSO4(H2SO4) |
氢氧化钠溶液 |
过滤 |
实验室制取气体所需装置如下图所示,请回答以下问题: 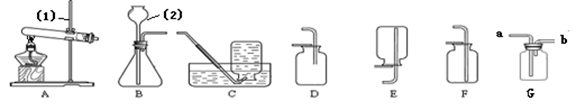
(1)图中标示仪器的名称(1) ,(2) 。
(2)实验室选用B和E装置可以制取的气体是 ,一般不用c装置收集CO2的原因是
。不选用D装置收集CO2的原因是 ,实验室如选用G装置收集二氧化碳,气体应该从 端进入。
(3)用高锰酸钾制取氧气时,选用的发生装置是 ,反应的化学方程式为 。如果要制得较纯净的氧气应该选择装置 收集。
在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。浊液中白色沉淀物质是 和 。
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①: ; 猜想②:Na2SO4;
猜想③:Na2CO3; 猜想④: 。
【实验探究】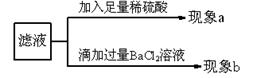
若现象a只有白色沉淀,则猜想 成立;若现象a只有气泡产生,则猜想 可能成立,涉及的反应方程式是 ;若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想 成立,若沉淀全部不溶解,则猜想 成立。
课外小组研究“影响H2O2生成O2反应速率的因素”的课题。通过查阅资料,他们提出如下猜想。
【提出猜想】催化剂和反应物浓度都会影响H2O2生成O2 的反应速率
【实验过程】实验装置如图:
实验操作:检查装置的气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。
实验记录:
| 实验编号 |
① |
② |
③ |
| 反应物 |
5%H2O2 50 mL |
5%H2O2 |
3%H2O250 mL |
| 加入固体 |
0.5gCuO |
0.5gMnO2 |
0.5gMnO2 |
| 收集等体积O2所需时间 |
105 s |
45s |
78 s |
(1)实验②中加入H2O2溶液的体积为 mL;
(2)充分反应后,将实验②中剩余物质里的MnO2提取的方法是 ;
【结论】该探究过程得出的结论是 ;
【反思】 H2O2在常温加入MnO2 后反应速率加快。小敏提出,为了更好的证明二氧化锰是否对H2O2生成O2的反应速率有影响,还应该增加一组对比实验。该实验选用的药品和用量为 ;
【实验拓展】小敏用收集的气体进行氧气的性质实验。
(1)铁丝在氧气中燃烧,其反应的化学方程式为 ;
(2)小敏发现用收集的气体进行铁丝燃烧实验时,没有产生明显的火星四射现象。造成这种结果的可能原因是 。
除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
| 选项 |
待提纯的物质 |
除去杂质的方法 |
| A |
KCl(MnO2) |
加水溶解、过滤、蒸发、结晶 |
| B |
FeSO4溶液(CuSO4) |
加入适量的锌粉,过滤 |
| C |
NaCl溶液(FeCl3) |
加入过量NaOH溶液,过滤 |
| D |
CuO(炭粉) |
加入适量的稀盐酸,搅拌,过滤,蒸发 |
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置“504双吸剂”固体样品很好奇,设计实验进行探究。
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
久置固体中可能含有Ca(OH)2的原因是(用化学方程式表示) 。
【实验探究1】
甲同学的方案:
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 |
固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 |
固体中一定含有 和氢氧化钙。 |
| (2)另取少量固体放于试管中,滴加足量的 。 |
固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 |
固体中一定含有 , 一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 |
|
固体中一定含有CaCO3 |
【实验质疑】
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是 。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是 。
【实验探究2】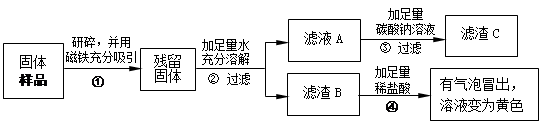
乙、丙同学设计如下实验方案继续验证:
(1)乙、丙同学实验中又能得出固体样品中一定还含有 。
(2)乙同学经过实验测得上述滤渣C(CaCO3 )的质量为1.0 g,计算滤液A中含氢氧化钙的质量。(写出解题过程)
丙同学经过实验测得上述残留固体中含钙物质的总质量为1.6 g,滤渣B中CaCO3的质量为1.0 g。
【实验结论】综合上述实验及乙、丙同学的数据,久置固体的成分是 。
能源“非石油化”是战略目标,发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下图为天然气合成氨的工艺流程。
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是 。
(2)①处加入Fe2O3·H2O的目的是 。
(3)③处一般加入K2CO3溶液以吸收CO2 ,K2CO3溶液与CO2反应生成碳酸氢钾(KHCO3),该反应的化学方程式是 。
(4)右图是实验室模拟合成氨气的装置

(反应方程式:N2+3H2=2NH3)甲装置的作用有三个:一是将氮气和氢气干燥;二是使氮气和氢气充分混合;三是 ,从而提高氮气和氢气的利用率。
(5)该流程中参与循环的物质是 。
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑),这种工业成为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究。
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是 (用化学方程式表示) 猜想二:可能含有NaCl,作出此猜想的依据是 (用简洁的文字表述)。  II.定量探究
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程)。
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性。
(2)探究方案中因缺少 (填操作名称),导致测得的氢氧化钠的质量分数偏小。