除去下列物质中的少量杂质所用的试剂或方法都正确的一组是( )
| 选项 |
物质 |
杂质 |
除去杂质的试剂或方法 |
| A |
加入过量的稀盐酸、过滤、洗涤、干燥 |
||
| B |
将气体点燃 |
||
| C |
加水溶解、蒸发溶剂 |
||
| D |
加足量的水、过滤、干燥 |
已知A、B、C、D是中化学常见的物质.它们之间的相互转化关系如图所示.其中A被看作是理想的"绿色能源",B在常温下是一种无色液体,C可用于灭火.(部分反应物、生成物和反应条件未标出)

请回答下列问题:
(1)写出A在空气中燃烧的主要现象:,放出大量的热.
(2)写出B→A的化学方程式:,其基本反应类型为.
(3)若D是有机物,其化学式为.
(4)若D是无机物,写出B→D的化学方程式:.
A~F是初中化学常见的物质,它们存在如图所示的关系("一"表示两物质间能反应,""表示一种物质转化成另一种物质.部分生成物和反应条件已略去).A、B、C三种物质中都含有碳元素,A为黑色固体;D、E、F三种物质中都含有钙元素,F可作干燥剂.请回答下列问题:
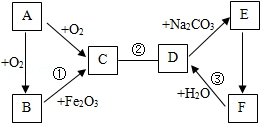
(1)A的化学式为.
(2)反应③能(填"吸收"或"放出")热量.
(3)写出反应①和②的化学方程式:①.②.
某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6
固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.

请计算:
(1)固体样品中氧化铁的质量是克.
(2)在上述反应后的固体中加入100
稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
氢化钙(
)固体是登山队员常用的能源提供剂.某化学兴趣小组拟用如图1所示的装置制备氢化钙,其反应的化学方程式为:
.

(1)
中钙和氢元素的化合价分别为,装置中的无水氯化钙干燥装置也可用来代替.
(2)利用该装置进行实验,步骤如下:检查装置的气密性后装入药品,打开分液漏斗活塞:(请按正确的顺序填入下列步骤的序号).
①加热反应一段时间 ②收集气体并检验其纯度 ③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再连接一装置
,装置
中加入的试剂是.若氢气未充分干燥,装置X中的现象为.
(4)为了测量上述实验中制得的氢化钙的纯度,该小组称取mg所制得样品,按如图2所示装置进行测定.旋开分液漏斗活塞,反应结束后充分冷却,注射器活塞由反应前的V1mL刻度处变化到V2mL刻度处(V2<V1,气体密度为dg/mL)
①橡胶管的作用为:a;b..
②旋开分液漏斗活塞后,除发生
的反应外,还最有可能发生的反应为.
③用w表示氢化钙的纯度,请用一个等式表示出d、V1、V2和w之间的关系.
④该小组乙同学认为去掉连接的注射器,也要计算出氢化钙的纯度.他同样称取mg样品,加入烧瓶中后称取反应前的质量为m1g,反应后的质量为m2g.乙同学表示出的m,m1,m2和w之间的关系的等式为.
小宁和小明同学学习完酸、碱、盐后发现:碱溶液能使酚酞试液变红,
溶液也能使酚酞试液变红.碱溶液使酚酞试液变红,是因为碱在水中解离出
,那么
溶液中究竟是哪种粒子使酚酞试液变红呢?小宁设计了如图三个实验,请你、小宁和小明一起探究并完成下列问题:

(1)
属于(填"酸"、"碱"、"盐");
(2)实验Ⅰ的目的是为了;
(3)实验Ⅱ加入蒸馏水的目的是探究水分子是否能使酚酞试液变红,小明同学认为实验Ⅱ没必要做,你认为小明的理由是;
(4)实验Ⅲ滴入
溶液,震荡,酚酞试液变红,向变红后的溶液中再逐滴滴加过量的
溶液后,震荡,红色逐渐消失,同时还观察到生成了(提示:
溶液呈中性)
由实验Ⅰ、Ⅱ、Ⅲ得出结论:溶液中的
以使酚酞试液变红;
(5)小明同学在和老师交流上述结论时,老师说:"其实
溶液能使酚酞试液变红也是由于溶液中存在
."你认为
溶液中存在
的原因是.
100
某一定质量分数的稀硫酸恰好与13
锌完全反应.请计算:
(1)反应产生氢气的质量是
.
(2)稀硫酸中溶质的质量分数.(写出计算过程).
氧化铜能与多种物质反应,能否与氨气(
)反应呢?在老师的指导下,某同学进行了探究.(注:无水硫酸铜遇水变蓝)
【实验设计】按图设计组装好仪器,检查气密性,装入药品.

【进行实验】
(1)
中氧化铜全部转化成光亮的红色固体
(2)
中
形管内物质变蓝;
(3)
中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是。
(4)从
中水槽里取适量液体于试管内,向试管里滴入无色酚酞试液,溶液呈色,原因是。
【实验结论】氧化铜和氨气发生反应,化学方程式是。
【继续探究】(1)测得有关数据如下表
| 质量 |
实验前 |
实验后 |
| 氧化铜粉末+玻璃管 |
(2)
中玻璃管内的反应证明,氨气的化学性质与有相似之处(填物质化学式)
下列叙述与对应的坐标图表示正确的是()

| A. |
向一定量的二氧化锰中加入过氧化氢溶液

|
| B. |
将相同质量的
粉和
粉分别加入足量的稀盐酸中

|
| C. |
在一定量
和
的混合溶液中加入铁粉

|
| D. | 加热一定量的高锰酸钾固体 |
一块表面被氧化的铝片质量为15.6g,将其放入烧杯中,加入213g稀硫酸,恰好完全反应,反应后,称得烧杯中的溶液质量为228g,求:(提示: )
(1)生成氢气的质量为g;
(2)反应后所得溶液中溶质的质量分数.
推断题:物质之间的转化关系如图所示,部分产物和反应条件已省去.

(1)金属B的活动性金属D的活动性(填">"、"<"、"=");
(2)若A是一种气体化合物,写出①的化学方程式:;
(3)向C溶液中加入
溶液,有白色沉淀,加入稀硝酸,沉淀不溶解,写出其化学方程式;
(4)写出溶液C与
溶液反应的化学方程式:.
据央视报道:2013年6月10日上午我国自行研制的"蛟龙"号潜艇,承载14位科学家再次深海科学考察.潜水艇中可用过氧化钠
作供氧剂,净化室内空气.为探究其反应原理,某学习小组学生在老师指导下,进行了如下探究实验,请你参与并回答下列问题:
【查阅资料】
过氧化钠常温下能与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气.
(1)请写出过氧化钠与水反应的化学方程式.
【实验设计】
为探究二氧化碳与过氧化钠的反应,并验证反应产物.选用如图仪器和如图实验装置.

(2)用
处做二氧化碳的发生装置,装配该装置时,应选用的仪器除带导管的双孔塞外,还需要上述的仪器有,(填名称).写出制取二氧化碳气体的化学方程式.
(3)为了体现
与过氧化钠反应,且E中只收集到氧气一种气体,请选用适当的实验装置,填写装置导气管的连接顺序是
.
【实验验证】
(4)用,证明装置E中收集的气体是氧气.
(5)检验装置
中反应后剩余固体物质的成分:
①取少量
中反应后的固体于试管中,滴加少量的,观察到的实验现象,说明含有过氧化钠.
②再向试管的溶液中,滴加,观察到的实验现象,说明装置
反应后生成碳酸钠.
某同学在学习溶液的酸碱性时发现盐溶液
呈中性
溶液呈碱性,该同学认为有可能有的盐溶液会呈酸性,上网查资料发现
,
溶液呈酸性.该同学来兴趣了写出如下的学习小结,请你做一做:
(1)盐溶液
的可能为(将你的假设填入空格中)①②③
=7
(2)要测定该溶液的酸碱性用,如要知道该溶液的酸碱度可用.操作方法.
(3)"庄稼一枝花,全靠肥当家."
是一种氮肥能促进农作物的茎、叶生长茂盛,能使紫色石蕊试液变色.
(4)铵态氮肥的检测方法是:.
(5)该同学加热
溶液发现有红褐色沉淀生成,请写出化学方程式:.(提示:
等难溶性碱在
>5盐酸中不溶解)
(6)为什么
溶液呈碱性,
,
溶液呈酸性,上网查不是很明白,是高中要学的,等上高中后我一定要搞清楚.
下列除去杂质的方法,正确的是()
| 选项 |
物质(括号内为杂质) |
去除杂质的方法 |
| A |
溶液(
) |
加入适量的稀盐酸 |
| B |
(
) |
通入
溶液再用浓硫酸干燥 |
| C |
加过量
溶液,过滤 |
|
| D |
溶解,过滤,蒸发 |
某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究.请你参与.
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由色变为无色.结论:两种物质发生了反应.反应的化学方程式为.
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有
;猜想二有
和
;猜想三,有
和
.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 |
方案1 |
方案2 |
方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) |
 |
 |
 |
| 实验现象 |
对比标准比色卡:pH<7 |
产生白色沉淀 |
|
| 实验结论 |
溶液中有 | 溶液中有
|
[实验结论]丙认为猜想三正确.
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是.
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为.
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
| 要分离的盐 |
所用试剂 |
主要操作 |
|
|