[江苏]2013届江苏省扬州市扬中教育集团树人学校九年级中考第三次模拟考化学卷
下列各组物质按酸、碱、盐、氧化物顺序排列的一组是
| A.碳酸、乙醇、氯化钠、水 | B.硫酸、纯碱、硝酸钾、干冰、 |
| C.硝酸、熟石灰、碳酸钙、水银 | D.醋酸、苛性钠、纯碱、氧化钙 |
2013年初,我市曾多次出现大面积雾霾天气。其中PM2.5对人体健康和环境质量的影响很大。下列措施对PM2.5的治理起不到积极作用的是
| A.城市道路定时洒水 | B.大力发展煤炭发电 |
| C.大力植树造林 | D.控制建筑工地扬尘 |
稀土元素铕(Eu)是激光及原子能应用的重要材料。已知氯化铕的化学式为EuCl3,则氧化铕的化学式为
| A.EuO | B.Eu2O3 | C.Eu3O2 | D.EuO3 |
钙可以促进青少年骨骼发育,这里的“钙”应理解为
| A.元素 | B.离子 | C.原子 | D.分子 |
牙膏中的含氟化合物对牙齿有保护作用。一种氧原子的原子核内有8个质子和8个中子,该原子的相对原子质量约为
| A.14 | B.15 | C.16 | D.17 |
下列有关实验现象的描述,正确的是
| A.铁丝在空气中剧烈燃烧、火星四射、生成黑色固体 |
| B.分别点燃一小段棉纱线和羊毛线,都产生了烧焦羽毛的气味 |
| C.将食醋与纯碱混合有大量气泡产生 |
| D.木炭在氧气中燃烧产生大量白烟 |
下列鉴别方法或现象、结论正确的是
| |
鉴别对象 |
方法、现象、结论 |
| A |
硬水和软水 |
分别加入肥皂水,泡沫少,无垢状物的为硬水 |
| B |
一氧化碳和二氧化硫 |
分别闻气味,有刺激性气味的是一氧化碳 |
| C |
淀粉和葡萄糖 |
分别滴加碘水,呈现蓝色的是淀粉 |
| D |
铁和铜 |
分别通电,不能导电的黄铜 |
某发电厂烟气处理的新工艺:CH4十2NO2=N2+X+2H2O,则X的化学式为
| A.CO | B.CO2 | C.O2 | D.C |
下图是工业上制备氢气的微观示意图,其中不同的“球”代表不同的原子。下列说法不正确的是
A.图中能表示氢分子的是 |
| B.反应前后,原子的种类、数目不变 |
| C.该反应中共涉及两种单质和两种化合物 |
| D.该反应中参加反应的两种分子的个数比为1 :1 |
放学回家后,小明同学泡了一杯白糖开水。他用筷子充分搅拌杯中的白糖后,将杯子放在一边待糖水变凉。喝糖水时,发现杯底有少量未溶解的白糖(如图所示)。下列操作或现象能说明糖水一定属于饱和溶液的是 
| A.泡糖水时进行了充分搅拌 | B.糖水热的时候白糖全部溶解 |
| C.凉的糖水底部有剩余的白糖 | D.喝糖水时感到很甜 |
【戊二醛(C5H8O2)是一种高效消毒剂,下列有关戊二醛的说法不正确的是
| A.戊二醛属于有机高分子化合物 |
| B.戊二醛由碳、氢、氧三种元素组成 |
| C.戊二醛中碳、氢、氧的原子个数比为5︰8︰2 |
| D.戊二醛的相对分子质量为100 |
下列实验操作中错误的是
| A.蒸发结晶 | B.检查气密性 | C.滴管用毕即插回 | D.测定溶液的pH |
除去下列物质中的少量杂质(括号内是杂质),所用试剂及方法均正确的是
| A.铜粉(碳粉)——在空气中灼烧 |
| B.氯化亚铁溶液(氯化铜)——加过量的锌粉、过滤 |
| C.氢氧化钠(碳酸钠)——加适量的稀盐酸、蒸发 |
| D.一氧化碳(二氧化碳)——通过足量的氢氧化钠溶液、干燥 |
食品安全关系到人体健康,下列说法正确的是
| A.霉变的米中含有黄曲霉素不能食用 |
| B.食品添加剂是安全,可以放心大量使用 |
| C.用甲醛浸泡水产品,延长保质期 |
| D.将地沟油回收作为食用油 |
甲、乙的溶解度曲线如图,将t2℃甲、乙的饱和溶液分别降温到t1℃.下列说法一定正确的是
| A.两溶液仍饱和 | B.甲溶液仍饱和 |
| C.溶质质量分数:甲>乙 | D.溶液质量:甲=乙 |
氢氧化铝[Al(OH)3]受热易分解,产生水并吸收热量,故可用作阻燃剂;能与盐酸、
NaOH溶液反应,是药物“复方胃舒平”的主要成分之一。实验室制备Al(OH)3方法为: Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4,通常不选用NaOH。下列判断不正确的是
| A.氢氧化铝的热稳定性好 |
| B.复方胃舒平可用于治疗胃酸过多症 |
| C.氢氧化铝可灭火的原因之一是降低了可燃物的温度 |
| D.实验室不用NaOH溶液制备Al(OH)3是因为NaOH会与Al(OH)3反应 |
一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列关于该反应的说法中,正确的是
| 物质 |
W |
O2 |
CO2 |
H2O |
| 反应前质量/g |
23 |
64 |
8 |
5 |
| 反应后质量/g |
0 |
16 |
X |
32 |
A.X的值为52 B.W由碳、氢两种元素组成
C.该反应属于置换反应 D.W中碳、氢元素质量比为4∶1
右图以稀硫酸为例的反应关系体现了酸的化学性质。下列说法正确的是 
| A.X所表示的物质类别是盐 |
| B.图中涉及到置换、化合、复分解三种基本反应类型 |
| C.图中能生成盐的反应包括②③④⑤ |
| D.若X溶液既能跟稀硫酸反应,又能跟Ca(OH)2反应,则X可能是BaCl2 |
(1)用化学用语表示:
①2个氮原子 ; ②氧化镁中镁元素显+2价 ;
③2个镁离子 ; ④人体中含量最多的金属元素 ;
⑤2个水分子 ; ⑥纯碱 。
(2)有六种物质:
| A.熟石灰、 | B.活性炭、 | C.干冰、 | D.钛合金、 |
E.聚乙烯、F.硝酸钾。请选择相应物质的序号填空:
①可用于人工降雨的是 ; ②可作复合肥的是 ;
③可用于改良酸性土壤的是 ;④可用于制食品包装袋的是 ;
⑤能吸附冰箱异味的是 ; ⑥可用来制造人造骨的是 。
(3)概念间存在着如下关系,其中单质和化合物属于 关系;浓溶液和饱和溶液应属于 关系。
A、B、C、D是四种粒子的结构示意图.请回答:
(1)写出C图表示的微粒属于 ;(选填“原子”、“阳离子”或“阴离子”)
(2)A、B、C、D属于同种元素的粒子是 (填序号);
(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似 (填序号)
2013年世界水日的宣传主题是“水合作”。请回答以下相关问题:
(1)从组成角度看:水是由 组成的。
(2)从结构角度看:水是由 成的(填“分子”或“原子”或“离子”)。
(3)每年的3月22日为“世界水日”。水资源的安全和合理使用已受到人们的普遍关注,请回答以下相关问题:
①硬水是 (选填“纯净物”或“混合物”),生活中既能降低水的硬度,又能杀菌消毒的方法是 。
②自来水厂常用二氧化氯做消毒剂,二氧化氯中氯元素显 价。自然界中的水都不是纯水,活性炭用于净水是因为它具有良好的 性。
③近几年我国不少水域多次发生“赤潮”、“水华”现象,这主要是水体富营养化导致水中的藻类生长繁殖过快所引起的。已知藻类含有C106H263O110N16P的物质,则工业和生活污水中导致藻类生长过快的营养元素是 (填元素符号)。
有一种牙膏侧面的标签如右图:
(1)单氟磷酸钠的化学式是Na2PO3 F,其相对分子质量为 。
(2)该支牙膏含氟的质量为 g。
(3)牙膏水溶液能使pH试纸变蓝,则其呈 (填“酸"“中"或“碱”)性。
(4)可用草酸铵[ 化学式为(NH4)2C2O4 ]检验牙膏摩擦剂中阳离子,生成草酸钙沉淀,草酸铵和氯化钙溶液反应的化学方程式为 ,该反应的基本类型为 反应。
(5)某同学设计如下实验方案测定牙膏中钙元素的质量分数:向一定量牙膏中加入过量稀盐酸,测定生成CO2的质量,据此计算牙膏中钙元素的质量分数。小李同学认为即使排除实验仪器和操作的影响,上述测定的结果仍不一定准确,理由是 。(填字母,2分)
A.牙膏中可能存在其他碳酸盐,会导致结果偏高;
B.牙膏中可能存在着其他含钙的化合物,会导致结果偏低
下图为实验室常用的实验装置,请回答问题:
(1)写出带有标号仪器的名称:① ;② 。
(2)若用A、C装置组合制取O2,当看到水槽中气泡 (填“刚一冒出”或“连续均匀冒出”)时,开始收集。收集完毕时,应先 (填“熄灭酒精灯”或“从水中取出导管”),其目的是 。
(3)写出用B、E装置组合制取某气体的化学反应方程式 。
(4)H2S是有毒气体,溶于水成氢硫酸。实验室常用块状硫化亚铁(FeS)和稀H2SO4
在常温发生复分解反应制H2S。某同学用G装置来收集处理H2S。
①实验室制H2S的化学方程式为 。
②用G装置来收集处理H2S,说明其密度比空气 。
③G装置中氢氧化钠溶液的作用是 ,漏斗的作用是 。
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(主要含有FeCl2和CuCl2)处理和资源回收的工业流程如下:
试回答下列问题:
(1)过程①中Cu和FeCl3反应的化学方程式: ;过程②加入铁屑后发生的置换反应的化学方程式: ;
(2)步骤②得到滤渣的成分是 ;步骤③的操作是过滤、 、干燥等。
(3)Fe(OH)2与O2和H2O反应生成 色Fe(OH)3。写出相关的化学方程式为: 。
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验。试回答:
【查阅资料】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解生成CO2和CO。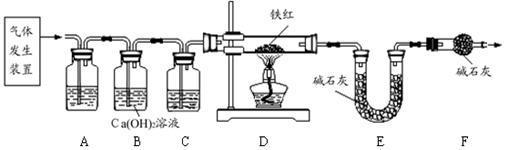
(1)实验前应先 。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是 、C中的试剂是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是 。
(4)某同学认为图示装置有不足之处,改进的方法是 。
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy + y H2 x Fe + y H2O,Fe3C + 2 H2
x Fe + y H2O,Fe3C + 2 H2 3 Fe + CH4。
3 Fe + CH4。
(1)写出焙烧中氧化铁与CO反应的化学方程式: 。
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 。
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知3 CH4 + 4 Fe2O3 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A处、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量。
操作的先后顺序是①→③→ →⑤→⑥→⑦(填字母)
A.②→④ B.④→②
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;
(5)若缺少装置D,则所测氧元素的质量分数将 (填“偏大’’“偏小"或“不变")。
(6)粗还原铁粉样品的质量为20.000 g,装置B、E分别增重0.360 g和0.440 g,则计算样品出中碳元素的质量分数是 ,氧元素的质量分数是 。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号