如图是某种薯片的包装袋,里面被一种气体充得鼓鼓的.小明对这种气体产生了兴趣,
请你和小明一起对该气体进行探究.

【提出问题】该气体可能是什么呢?
【查阅资料】食品和氧气接触容易被氧化而腐败;常填充某种气体以防腐.
【作出假设】包装袋中的气体一定不能是_________________
| A.二氧化碳 | B.氮气 | C.空气 | D.氧气 |
【进行实验】同学们进行了进一步探究,请你帮该组同学完善探究过程,具体操作如下:
| 实验方法 |
可能观察到的现象和结论 |
| 用注射器抽取包装袋的气体,并将气体注入_______________________中,观察现象。 |
_________________________,说明包装袋中装的不是二氧化碳。 |
| 用排水法继续收集一瓶该包装袋内的气体,并向集气瓶中伸入燃着的小木条,观察现象。 |
_______________,说明包装袋中的气体可能是__________。 |
【反思讨论】根据食品防腐气体应具备的要求,你认为包装袋内充的气体还可以是_________。
小明同学选择“影响过氧化氢溶液制取氧气的因素”的课题开展探究。下列是他探究实验数据记录,
| 实验序号 |
反应温度/℃ |
催化剂二氧化锰的用量/g |
过氧化氢溶液的浓度 |
反应所需的时间/分钟 |
| 1 |
15 |
0 |
5% |
30 |
| 2 |
15 |
1g |
5% |
10 |
| 3 |
25 |
1g |
10% |
5 |
| 4 |
25 |
1g |
15% |
3 |
| 5 |
35 |
1g |
15% |
1 |
(1)过氧化氢溶液制取氧气的文字或符号表达式为 ;
(2)实验 和 (填序号),说明二氧化锰能加快过氧化氢溶液分解放出氧气的速度;
(3)对比实验3和4,可得出的结论是 ;
(4)通过对比实验得到影响过氧化氢溶液制取氧气速度的因素有 。
A.溶液的温度 B.溶液的浓度 C.催化剂的种类
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 。
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。

【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论[ |
| |
|
(4)为了证明镁可在氮气中燃烧生成氮化镁,小红又设计了如下方案进行验证。

步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤②:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的 左右。
步骤③:往水槽中加水使广口瓶内外水面相平;点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
A.步骤②的目的是 。写出红磷在氧气中燃烧的化学方程式
B.在步骤③“待冷却后广口瓶内水位继续上升”是由于瓶内气压 (选填“大于” “小于”或“等于”)外界气压
C.写出镁在氮气中燃烧生成氮化镁的化学方程式
【反思与交流】
(5)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释 。
小明发现双氧水滴在伤口上会产生大量的气泡,于是他查阅了相关资料:双氧水分解可以用二氧化锰(MnO2)、氧化铁(Fe2O3)等物质作催化剂,对此他展开了探究。
【提出问题】氧化铁是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小明以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
| 实验序号 |
氯酸钾质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
/ |
|
| ② |
1.2g |
Fe2O3 0.5g |
|
| ③ |
1.2g |
MnO2 0.5g |
|
①上述实验应测量的“待测数据”是 。
②若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铁能加快氯酸钾的分解。
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g红色粉末(Fe2O3),这样做的目的是 ,小明同学认为氧化铁肯定是氯酸钾分解的催化剂,但晓航同学对此提出了异议,晓航同学设计了如下实验:
将第二次精确称量得到的0.5g红色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃。
晓航同学这样做目的是 ,
【预期结论】氧化铁也能作氯酸钾的催化剂。
【评价设计】你认为小明设计实验③和实验②对比的目的是 ;
写出实验②反应的符号表达式 。
小明和小红对市场上销售的一种真空充气包装的形如小枕头“蛋黄派”发生了兴趣,如下图所示.他们查阅资料获知:这种真空充气包装技术,即将食品装入包装袋,抽出包装袋内空气,再充入某种气体,然后封口.它能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形.那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳.
请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤(方法、现象和结论):
| 实验步骤 |
现象 |
结论 |
| 用注射器抽取袋内气体,然后通入澄清的石灰水。 |
|
|
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶体积相同、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
【进行实验】图示是他们进行实验的装置图,气体发生装置中A仪器的名称是:_________,此实验中B处宜采用的气体收集方法是_____________。
【实验记录】
| 实验编号 |
1 |
2 |
| 反应物 |
6% 过氧化氢 |
6% 过氧化氢 |
| 催化剂 |
1 g红砖粉 |
1 g 二氧化锰 |
| 时间 |
152 s |
35 s |
【结论】该探究过程得出的结论_____________________。
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快。若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的___________和_________是否变。
过氧化氢生成氧气的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出假设和实验方案)
小明和小红对市场上销售的一种分袋包装的蛋糕发生了兴趣,包装蛋糕的塑料袋被气体充得鼓鼓的,看上去好像一个小“枕头”。他们认为这种包装技术,主要是为了延长蛋糕的保质期,同时避免蛋糕被压变形。那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出实验步骤: 。
(2)小明的猜想如果正确,现象应是 。
(3)你认为食品充气包装,对所充气体的要求是① ② 。
铜是一种常用的金属,纯净的铜颜色为紫红色,它能够和硝酸银溶液发生化学反应,生成硝酸铜和银单质。某同学设计下表所示实验,探究金属铜对过氧化氢溶液分解速率的影响。
| 操作 |
装置 |
现象 |
| 1、取一小块铜丝网,卷成筒形,固定在铜丝上。 |
 |
 |
| 2、分别向①和②中注入15mL、30%的H2O2,并放入盛有热水的③中。 |
 |
约1min后可观察到①和②中都有少量气泡产生 |
| 3、把铜丝插入①中。 |
 |
①中有大量气泡产生,约5min后不再有气泡产生;此时②中仍然有少量气泡产生 |
(1)仪器②中实验的目的是__________________________;
(2)根据上述实验,可以得出的结论是______________________________;
(3)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是___________________。
A.称量实验前铜丝网的质量 B.将实验后的铜丝网干燥、称重
C.向仪器中加入二氧化锰 D.将实验后的铜丝网插入AgNO3溶液中。
某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
一、为探究催化剂的种类对双氧水分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g 10%过氧化氢溶液与1.0g MnO2均匀混合
Ⅱ.将x g10% H2O2溶液与1.0g CuO均匀混合
在相同温度下,比较两组实验产生O2的快慢。
(1)为了Ⅰ与Ⅱ中对比x的值应为 。
(2)甲选用下列装置测量产生O2的快慢,正确的是 (填编号)。

二、探究影响双氧水分解速度的某种因素。实验数据记录如下(常温通常指20℃)
| 实验 |
温度 |
药品 |
氧气体积/ml |
反应所需时间/s |
|
| ① |
常 温 |
5% H2O2 |
|
0 |
|
| 常 温 |
5% H2O2 |
MnO2 |
125 |
20 |
|
| ② |
常 温 |
5% H2O2 |
MnO2 |
125 |
20 |
| 热水中 |
5% H2O2 |
MnO2 |
125 |
18 |
|
| ③ |
常 温 |
5% H2O2 |
MnO2 |
125 |
20 |
| 常 温 |
30% H2O2 |
MnO2 |
125 |
5 |
(1)通过实验①对比可知,化学反应快慢与 有关。
(2)通过对比实验 可知,反应物浓度大,反应速率快。
(3)除了上述的两个因素能影响化学反应快慢,你认为另一个影响因素是 ,其关系是 。
(4)由上述实验可知温度、浓度、催化剂等都是影响化学反应速率,实验室用过氧化氢制取氧气的最合适的条件是 。
为了探究物质在化学变化时,参加反应的反应物总质量与生成物总质量是否相等.甲、乙两个兴趣小组分别设计了如图所示的实验来验证自己的假设.
【查找资料】有关反应的化学方程式:
甲组:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4;乙组:Na2CO3+2HCl═2NaCl+H2O+CO2↑
【实验方案】

【进行实验】甲小组把盛有适量NaOH溶液的小试管放入盛有CuSO4溶液的烧杯中,乙小组把盛有适量稀盐酸的小试管放入盛有a2CO3溶液的烧杯中.然后他们分别将烧杯放到天平上,用砝码平衡,接着取下烧杯并将其倾斜,使试管内的溶液和烧杯内的溶液混合发生反应,待反应后再把烧杯放在天平上,观察天平是否平衡.请回答:
【实验现象】反应后,甲小组的天平指针指向刻度盘的 ,乙小组的天平指针指向刻度盘的 (选填“左边”、“右边”或“中间”).
【解释和结论】甲小组的结论为: ;
乙小组的解释为: .
【反思与评价】比较两个小组的实验设计,若使用的试剂不变,应改进的是: ;由此,你得到的启示是:探究或验证反应物与生成物的质量关系时,若要用到有气体参加或有气体生成的反应,反应必须在 的容器中进行.
只有氧气才能支持燃烧吗?某学习小组对这个问题进行如下探究。
【信息给予】钠是一种银白色的金属,能与空气中的氧气与水蒸气反应。
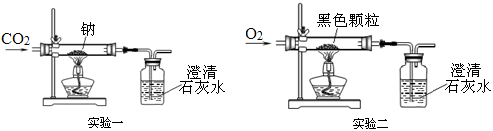
【提出问题1】除氧气外,是否还有其他物质也能支持燃烧。
【进行实验一】如图,向盛有金属钠(Na)的硬质玻璃管中通入纯净、干燥的CO2,当观察到澄清石灰水中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,钠剧烈燃烧,产生白烟,燃烧结束后玻璃管中有黑色颗粒和白色固体生成。
【得出结论】二氧化碳 (1) (“能”或“不能”)支持某些物质燃烧。
【反思评价】点燃酒精灯前,要先向玻璃管中通会二氧化碳,其目的是____(2)__ 。
【提出问题2】黑色颗粒和白色固体是什么?
【猜想与假设】黑色颗粒可能是 (3) (用化学式填写)。
【进行实验二】现象:黑色颗粒逐渐减少,澄清石灰水______(4)____。
【得出结论】实验二证明:黑色颗粒的猜想是正确的。
【猜想与假设】某同学对白色固体的成分做出猜想:(Ⅰ)碳酸钠 (Ⅱ)氢氧化钠。你认为猜想 (5) (填序号)一定是错误的,理由是 (6) 。
小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。
[提出问题]该淡黄色固体的化学成分是什么?
[查阅资料](1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
[设计实验方案]
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,你认为的最佳方案是 ,理由是(从环保、操作等角度分析) 。
【实验验证并得出结论】小明向盛有少量该固体的试管中加入2mL水,立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
小明想对生成的气体成分判断,他提出了以下两种假设:
①该气体是CO ②该气体是O2
你认为上述假设哪个更合理?________.理由是 。
请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
| 操作步骤 |
实验现象 |
结论 |
| |
|
|
该反应的符号表达式为__________________________。
[计算]在过氧化钠(Na2O2)中,①氧元素的化合价为 ;
②过氧化钠中钠、氧元素的质量比为 ;
③78克过氧化钠与___________克二氧化碳中所含氧元素的质量相等。
某实验小组的同学在整理实验仪器时,发现了一个盛有黑色固体的烧杯。在请教老师后,同学们得知烧杯中的固体是加热制取氧气的剩余物(反应完全),从中可以回收得到MnO2。小组同学将黑色固体取出,并对其进行了探究。
【查阅资料】①实验室中可以加热二氧化锰和氯酸钾(KClO3)固体的混合物制取氧气。其反应的文字表达式为:氯酸钾 氯化钾+氧气。
氯化钾+氧气。
②氯化钾溶于水,其水溶液呈无色;锰酸钾溶于水,其水溶液呈绿色。
③催化剂在化学反应前后,其质量和化学性质保持不变。
探究活动一:探究黑色固体是哪个化学反应的剩余物。
【猜想】猜想一:过氧化氢制取氧气;
猜想二:氯酸钾制取氧气;
猜想三: 制取氧气。
请写出猜想一制取氧气反应的表达式 ,
根据所学知识和以上信息判断,猜想一不成立,理由是 。
【进行实验】取少量黑色固体于另一个烧杯中,加入足量蒸馏水溶解,振荡,过滤后得到黑色滤渣和无色滤液。
【得出结论】猜想 成立,理由是 。
探究活动二:探究二氧化锰在氯酸钾固体加热制取氧气反应中的作用。
【猜想】猜想一:是反应物;猜想二:是催化剂。
【进行实验】
| 实验操作 |
实验现象 |
| 1、取12.25g氯酸钾在试管中加热,把带火星的木条伸入试管。 |
固体融化,产生少量气体,木条上的火星变亮。 |
| 2、取12.25g氯酸钾和2.0g二氧化锰混合均匀后在试管中加热,把带火星的木条伸入试管。 |
___________________。 |
| 3、待反应完全后,将试管中的剩余物加足量的水溶解,过滤,并将全部滤渣洗涤、干燥、称量。 |
称量固体的质量是_______g |
【实验结论】猜想二成立,二氧化锰在反应中起到催化作用。
【反思与交流】小贝同学提出,前面的实验不足以证明二氧化锰在这个反应中起到了催化作用,因为没有证明二氧化锰的 在反应前后不变。
研究性学习小组选择“可燃物燃烧剧烈程度与哪些因素有关”的课题进行探究。
【提出问题】可燃物燃烧剧烈程度与哪些因素有关?
【猜想与假设】可能与氧气的浓度有关。
【完成实验】按下表进行实验,并记录反应的现象。
| 实验编号 |
可燃物种类 |
集气瓶中气体 |
反应现象 |
| ① |
细铁丝 |
空气 |
无现象 |
| ② |
硫 粉 |
氧气 |
? |
| ③ |
细铁丝 |
氧气 |
燃烧且火星四射 |
| ④ |
硫 粉 |
空气 |
产生淡蓝色火焰 |
【分析现象,得出结论】
(1)表格中实验②中的现象是: ;
(2)写出铁丝在氧气中燃烧的文字表达式: ;
(3)由实验 对比,证明猜想合理;由实验①④对比,说明可燃物燃烧的剧烈程度还与 有关。
【反思】
(1)再举“氧气浓度影响可燃物燃烧剧烈程度”的例子:
(2)氧气的浓度还会影响可燃物是否完全燃烧,如煤在氧气不足时燃烧生成 有害气体。
你若还能提出新的合理的假设和实验方案,本题可奖励4分(化学试卷总分不超过100分)
【假设】
【实验方案】
某同学发现一瓶没有塞上瓶塞的过氧化氢溶液。查资料得知,过氧化氢溶液在光线的直射下也能分解成氧气和水。他想探究这瓶过氧化氢溶液是否已经完全分解,与同学们一起进行如下实验。
【猜想与假设】
猜想Ⅰ:这瓶过氧化氢溶液已经完全分解。 猜想Ⅱ:这瓶过氧化氢溶液未完全分解。
【设计实验】为了验证猜想,甲、乙、丙三位同学分别提出如下方案:
甲同学:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想Ⅰ成立,若带火星的木条不复燃,则猜想Ⅱ成立。同学们认为此方案不行,原因是_______________________。
乙同学:取等量的过氧化氢溶液于A、B两个试管中,向A试管中加入少量二氧化锰,再把带火星的木条分别伸入A、B试管中,若观察到_____________________,则猜想Ⅰ成立。该实验中,B试管的作用是_____________。
丙同学:
| 操作 |
现象 |
结论 |
| 取与甲同学等量的试剂于另一支试管中,加热,再伸入带火星的木条 |
_______________________ , ________________________ |
猜想Ⅱ 成立 |
【反思与交流】
① 敞口放置的试剂容易变质,所以要_________保存;过氧化氢溶液见光易分解,所以要存放在___________(填试剂瓶类型)中。
② 二氧化锰在过氧化氢的分解中起催化作用。从本组实验中可得知,能改变化学反应速率的方法还可以_______________________。