某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 。
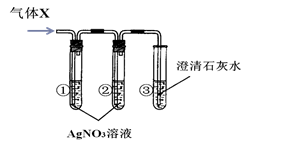
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。

【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
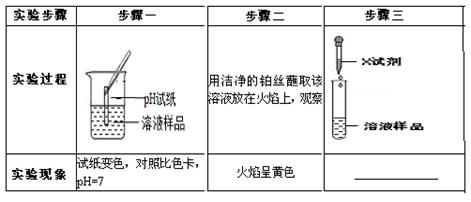
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论[ |
| |
|
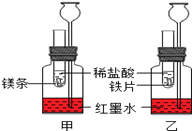
(4)为了证明镁可在氮气中燃烧生成氮化镁,小红又设计了如下方案进行验证。

步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤②:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的 左右。
步骤③:往水槽中加水使广口瓶内外水面相平;点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
A.步骤②的目的是 。写出红磷在氧气中燃烧的化学方程式
B.在步骤③“待冷却后广口瓶内水位继续上升”是由于瓶内气压 (选填“大于” “小于”或“等于”)外界气压
C.写出镁在氮气中燃烧生成氮化镁的化学方程式
【反思与交流】
(5)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号