有一包从海水中获得的粗盐,已经经过初步提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
一些物质的溶解性
|
OH﹣ |
Cl﹣ |
SO42﹣ |
CO32﹣ |
|
|
H+ |
溶、挥 |
溶 |
溶、挥 |
|
|
Na+ |
溶 |
溶 |
溶 |
溶 |
|
Ca2+ |
微 |
溶 |
微 |
不 |
|
Ba2+ |
溶 |
溶 |
不 |
不 |
|
Mg2+ |
不 |
溶 |
溶 |
微 |
探究过程:
Ⅰ.探究一:这包粗盐中可能有的杂质是CaCl2和MgCl2。
现用实验验证这种假设:取样品并溶解,加入数滴NaOH溶液,无明显现象,说明粗盐中无 ;另取样品并溶解,加入数滴碳酸钠溶液,有白色沉淀生成。
实验证明:这包粗盐中含有的杂质是 。
Ⅱ.探究二:这包粗盐中NaCl的质量分数。按下面步骤进行实验:
①称取ag的样品;
②将样品加水溶解,制成粗盐溶液;
③向粗盐溶液中加入过量的某种试剂,过滤,得到沉淀和滤液;
④将③中所得沉淀洗涤后小心烘干,称量得到bg纯净固体M;
⑤向③中所得滤液逐滴滴入稀盐酸,直到不再产生气泡为止后,移入蒸发皿蒸发,称量得到cg纯净固体N。
(1)②③⑤的步骤中,都使用到同一仪器是 ;它在步骤②和⑤中的操作方法相同,但目的不同,在步骤②中的目的是 。
(2)步骤③中加入的试剂是 ;目的是 。
(3)根据以上实验可知粗盐中NaCl的质量分数为 (用含字母的代数式表达)。
某溶液可能含有盐酸、硫酸、硝酸钾、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。下列相关说法正确的是( )

A.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡
B.加入氢氧化钡溶液至过量,共发生了三个化学反应
C.该溶液一定含有盐酸、氯化铜,可能含有硝酸钾
D.到达b点时所消耗氢氧化钡溶液中溶质的质量是34.2g
某化学兴趣小组以A装置为核心装置设计了如图系列实验:(固定装置的仪器已省略)

按如图所示连接仪器,检查整套装置的气密性良好,添加药品,固定装置,进行实验。
(1)关闭K2,打开K1,将H2O2溶液缓缓滴入锥形瓶中,待D装置中出现连续均匀气泡时点燃C装置中的酒精灯,观察到V型管内a处的硫燃烧,现象是 ,试写出在D装置中反应的化学方程式 ,待V型管内的硫燃尽后仍要继续通一段时间的氧气,目的是 。
(2)打开K2,关闭K1,继续将H2O2溶液缓慢滴入锥形瓶,观察到装置E中
(填现象),说明氢氧化钠和稀盐酸一定发生了反应。
(3)兴趣小组有同学提出疑问:E装置内反应后的废液中除酚酞以外还有哪些溶质呢?请你一起参与探究。
【作出猜想】
猜想一:NaCl
猜想二:NaCl和NaOH
猜想三: 。
【分析】以上有一种猜想一定错误,请写出错误猜想的序号及错误理由 。
【资料】NaCl的水溶液呈中性。
【设计并进行实验】排除了错误猜想后,为了验证其余猜想,同学们进行了如下实验:
|
实验操作 |
实验现象 |
实验结论 |
|
取少量E装置中的废液于试管中,并向其中加入① 。 |
② |
猜想三正确 |
【交流反思】该废液未经处理不能随意倒入水池。
为探究某化工厂固体废物的成分,以便回收有用物质,除掉有害物质。已知固体废物的主要成分是NaCl,还可能含有Na2CO3、K2SO4、NH4NO3、MgSO4、FeCl3,通过以下探究回答下列问题。

(1)气体乙的化学式为 。
(2)无色溶液A中存在的阴离子有 。
(3)反应生成气体甲的化学方程式为 。
(4)原固体废物中一定存在的物质有 。
碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:

假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
某学习小组对铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】
1.氯化钙固体可作干燥剂。
2.一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
3.常温常压,氢气密度是dg/mL。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行图1实验,现象如表1。
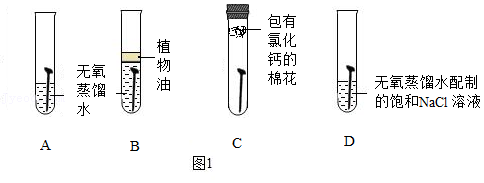
表1
|
试管 |
一周后现象 |
|
A |
铁钉表面有一层铁锈 |
|
B |
铁钉表面无明显变化 |
|
C |
铁钉表面无明显变化 |
|
D |
铁钉表面有较厚铁锈 |
(1)对比A、B、C试管中实验现象,说明铁锈蚀主要是与空气中的 发生化学反应。
(2)对比A、D试管中实验现象,说明铁锈蚀还与 有关。
(3)铁锈蚀后应及时除锈的原因是 。写出除铁锈的化学方程式 。
实验二:定量探究铁锈蚀的因素
小组设计了图2装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上,采集数据。
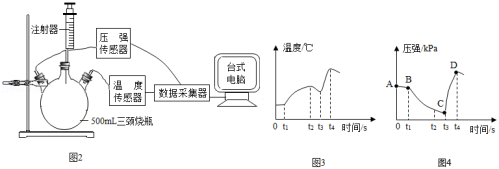
(4)据图3,t2时刻后反应并未停止温度却开始降低,原因是 。
(5)据图4,对比AB段和BC段说明 ,分析t3时刻后压强突然变大的原因是 。
实验三:测定铁锈含量
将实验二烧瓶中剩余物质过滤、洗涤、干燥,得mg固体,连接图5装置,检查气密性,加入固体与足量稀盐酸进行实验。

(6)完全反应后,常温常压下测得生成气体体积为VmL,则该固体中铁锈质量分数表达式为 。
(7)该实验条件下测得铁锈质量分数偏小的原因是 ,解决方法是 。
【反思与评价】
(8)与实验一对比,实验二铁锈蚀明显更快的原因是 。
早在春秋战国时期,我国就开始生产和使用铁器。某实验小组利用焦炭和Fe 2O 3模拟早期炼铁并检验可能的产物,实验装置如图:
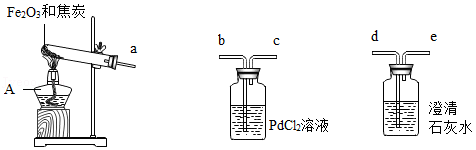
【查阅资料】①铁粉为黑色;常温下,Fe、Fe 3O 4可被磁铁吸引;
②PbCl 2溶液可用于检验CO,原理是:PdCl 2+CO+H 2O═Pd↓+CO 2+2HCl;
③Fe 3O 4与硫酸反应:Fe 3O 4+4H 2SO 4═FeSO 4+Fe 2(SO 4) 3+4H 2O。
【实验现象】澄清石灰水变浑浊,PdCl 2溶液中产生黑色沉淀,玻璃管内粉末全部变成黑色。冷却后,用磁铁靠近黑色固体,黑色固体被部分吸引。
(1)仪器A的名称是 。
(2)为了检验气体产物,装置从左到右的接口连接顺序为a→ → →
→ 。
(3)澄清石灰水变浑浊的化学方程式为 。
【实验结论】反应生成CO和CO 2,磁铁上的黑色固体可能是Fe、Fe 3O 4。
【提出猜想】磁铁上的黑色固体是什么?
猜想一:Fe
猜想二:Fe 3O 4
猜想三:Fe和Fe 3O 4
【设计实验】
|
设计思路 |
操作 |
现象 |
结论 |
|
定性实验 |
取少量黑色固体于试管中,加入足量稀硫酸,充分反应 |
固体完全溶解,产生气泡 |
猜想 成立 |
|
定量实验 |
取一定质量的稀硫酸(足量)放入烧杯中,加入5.6g黑色固体,充分反应后称量溶液的质量 |
固体完全溶解,产生气泡,溶液增加的质量为 g。 |
猜想一成立 |
【归纳总结】根据实验结论和探究结果C与Fe 2O 3反应的化学方程式为 。
实验室有一瓶敞口放置的氢氧化钠固体样品,为探究样品中的成分,小科进行如下实验:
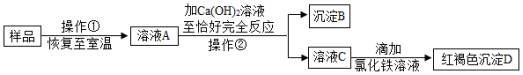
(1)操作①是加水充分溶解,操作②的名称是 。
(2)沉淀B的化学式是 。
(3)小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由 。
有一瓶气体,可能由O2、CO、CO2中的一种或几种组成为确定其组成,在老师的指导下,实验小组对该瓶气体进行了如下探究:
【查阅资料】脱氧剂(还原铁粉能够吸收氧气和水蒸气)。
【实验设计】用如图所示的装置进行实验(已略去夹持装置)。

【实验步骤】①检查装置气密性;②通入一定量氮气;③通入该气体,点燃酒精灯。
【实验现象】步骤③实验过程中,A装置无现象,B和F装置出现白色沉淀,E装置中出现光亮的红色物质。
【实验结论】该气体由 组成。
【实验反思】
(1)C装置的作用是 。
(2)步骤②通入一定量氮气的目的是 。
(3)E装置中氧化铜粉末发生反应的化学方程式为 。
有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。
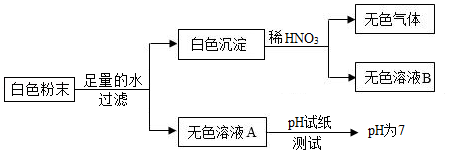
则:(1)无色溶液A中一定含有的溶质是 。
(2)白色粉末的成分是 。
小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2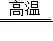 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
在我市贡井区、大安区交界处有个地名叫“石灰窑”,生产生石灰有悠久的历史。某校化学实验室一瓶装满生石灰的塑料试剂瓶已经膨胀破裂(如图),该校化学兴趣小组的同学在化学老师的指导下,对该生石灰取样开展了以下探究活动:

【提出问题】
生石灰样品的成分是什么?
【猜想假设】
生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
【设计实验】
兴趣小组设计出如下实验进行探究。
|
实验操作 |
实验现象 |
实验结论 |
|
|
(1) |
取样品于烧杯中,加水溶解,用手触摸烧杯外壁。 |
烧杯壁发热。 |
。 |
|
(2) |
将(1)中液体过滤,取少量滤液于试管中,向其中滴入 。 |
溶液变红。 |
有Ca(OH)2 |
|
(3) |
取(2)中的少许滤渣于试管中,向其中滴加足量稀盐酸。 |
。 |
有CaCO3 |
【反思评价】
(4)经过讨论,发现通过(2)不能得出样品中一定含有Ca(OH)2,理由是 。
(5)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。请写出生成CaCO3的化学方程式 。
【应用交流】
(6)生石灰要 保存。
【拓展延伸】
(7)兴趣小组在实验室制取二氧化碳气体的发生装置中连接上压强传感器如图一,测得实验过程中试管内气体压强变化情况如图二。下列说法正确的是 (填大写字母)。
A.ab段试管中液面逐渐上升
B.bc段石灰石与稀盐酸脱离接触
C.c点的对应操作是打开弹簧夹

在七十五届联合国大会上,中国提出努力争取2060年前实现“碳中和”,实现二氧化碳的“零排放”。化学兴趣小组认为实验室可用氢氧化钠溶液吸收多余的二氧化碳,从而实现实验室二氧化碳的“零排放”。小组同学对吸收后溶液中溶质的成分产生兴趣并进行探究。
【提出问题】氢氧化钠溶液吸收二氧化碳气体后,溶液中溶质的成分是什么?
【查阅资料】
(1)CO2与NaOH溶液反应会生成Na2CO3,当二氧化碳过量时,会继续反应生成NaHCO3。
(2)NaHCO3溶液呈弱碱性,一般不与CaCl2溶液反应,与稀盐酸反应产生气体。
(3)CaCl2溶液呈中性。
【作出猜想】
猜想①NaOH、Na2CO3
猜想②Na2CO3
猜想③Na2CO3、NaHCO3
猜想④NaHCO3
【实验与结论】
|
实验步骤 |
实验现象 |
实验结论 |
|
步骤一:取少量待测液于试管中,加入CaCl2溶液 |
产生白色沉淀 |
猜想 不成立 |
|
步骤二:另取少量待测液于试管中,加入过量CaCl2溶液至不再产生沉淀,过滤,取少量滤液,向其中加入适量稀盐酸 |
气泡产生(填“有”或“无”) |
猜想③不成立 |
|
步骤三:另取步骤二的少量滤液,向其中滴入2~3滴无色酚酞试液 |
试液变红 |
猜想 成立 |
写出步骤一中反应的化学方程式 。
【反思与交流】
反应物的量不同,可能导致生成物的种类不同。
【实验与结论】
|
实验步骤 |
实验现象 |
实验结论 |
|
步骤一:取少量待测液于试管中,加入CaCl2溶液 |
产生白色沉淀,是因为碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,说明溶液中含有碳酸钠 |
猜想④不成立 |
|
步骤二:另取少量待测液于试管中,加入过量CaCl2溶液至不再产生沉淀,过滤,取少量滤液,向其中加入适量稀盐酸 |
稀盐酸能和碳酸氢钠反应生成氯化钠、水和二氧化碳,无气泡产生,说明溶液中不含有碳酸氢钠 |
猜想③不成立 |
|
步骤三:另取步骤二的少量滤液,向其中滴入2~3滴无色酚酞试液 |
试液变红,是因为除去碳酸钠后溶液中仍然含有氢氧化钠,氢氧化钠溶液显碱性,能使酚酞试液变红色,说明溶液中含有氢氧化钠 |
猜想①成立 |
步骤一中碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式:
因发现青蒿素而获诺贝尔奖的科学家屠呦呦还发现了双青蒿素,查阅资料可知,双青蒿素由碳、氢、氧三种元素组成。为测定双青蒿素中碳、氢、氧三种元素的质量比。兴趣小组进行了以下探究。
【设计实验】兴趣小组设计并进行了如图一所示的实验。(装置气密性良好)
将7.1g双青蒿素放在装置C的玻璃管中,燃烧至无固体灰分残留。
(1)装置A、B中盛放的试剂分别是 (填序号)。
①足量NaOH溶液、足量浓硫酸
②足量浓硫酸、足量NaOH溶液
(2)装置F可吸收从装置E的气流中带出来的少量水蒸气,生石灰与水蒸气发生反应的化学方程式是 。
【记录数据】加热前,先通入空气一段时间,再称量装置D的质量、装置E和F的总质量(反应前的质量)。双青蒿素完全反应后,停止加热,继续通入空气一段时间,再次称量装置D的质量、装置E和F的总质量(反应后的质量),实验数据如表所示。
|
装置 |
反应前的质量/g |
反应后的质量/g |
|
D |
74.7 |
80.1 |
|
E和F |
80.3 |
96.8 |
【实验结论】(3)根据表中数据分析,双青蒿素中碳、氢、氧三种元素的质量比是 。
【拓展分析】(4)双青蒿素分子中碳、氢、氧三种原子的个数比是 。
【实验反思】(5)实验过程中,加热前要先通入空气一段时间,该操作的作用是 。
(6)有同学建议,为使实验结果更准确,需要在装置C和D之间增加图二所示的装置,其目的是 。
有一包白色粉末,可能含有Na 2CO 3、Na 2SO 4、K 2SO 4、NaCl、Ba(OH) 2中的一种或几种,为了探究其成分,实验过程如图所示:
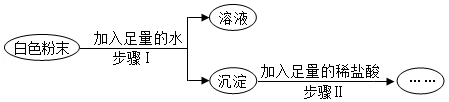
关于该实验的说法正确的是( )
A.步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有Ba(OH. 2、Na 2CO 3、K 2SO 4
B.步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有5种情况
C.步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有Ba(OH. 2、Na 2CO 3,可能有NaCl
D.步骤Ⅱ中沉淀不溶解,则原白色粉末一定有K 2SO 4,一定没有Na 2CO 3