为探究某化工厂固体废物的成分,以便回收有用物质,除掉有害物质。已知固体废物的主要成分是NaCl,还可能含有Na2CO3、K2SO4、NH4NO3、MgSO4、FeCl3,通过以下探究回答下列问题。

(1)气体乙的化学式为 。
(2)无色溶液A中存在的阴离子有 。
(3)反应生成气体甲的化学方程式为 。
(4)原固体废物中一定存在的物质有 。
有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验:

请回答:
(1)白色固体a的成分是 。
(2)固体样品中一定没有 。
(3)生成白色沉淀b的反应的化学方程式为 。
有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如图实验:

(1)取少量固体按图甲实验,根据步骤①可知固体中一定不含有 。
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随滴加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有 。
(3)取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,无色溶液C中一定含有的离子是
(填离子符号)。
(4)为进一步确定原固体中可能含有的物质是否存在,应采用的操作步骤是 ,通过观察现象即可确定。
为测定钢铁中的含碳量,设计如图装置。钢铁样品在装置A中煅烧时,气体产物只有CO2和SO2。

(1)钢样处理成粉末的主要目的是 ,钢样中的Fe3C煅烧时的化学方程式为
Fe3C+3O2 +CO2。
+CO2。
(2)实验室用KClO3和MnO2制备O2的化学方程式为 ,MnO2中Mn的化合价为 。
(3)装置B的作用是 ,装置B中的现象是 。
(4)装置C的作用是 ,若无装置C,则测定结果 (填“偏大”“无影响”或“偏小”)。
(5)装置D的作用是 ,装置E的作用是 。
(6)钢样中加入某物质可降低煅烧温度,为不影响测定结果,该物质在组成上需满足的条件是 。
无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO2、Fe2O3、MgSO4等杂质)为原料,生产无水氯化钙的流程如图:

回答下列问题:
(1)从流程图中推知:SiO2具有的化学性质是 。
(2)加入BaCl2溶液的主要作用是 。
(3)滤渣3中除有Ca(OH)2外、还有 (填化学式)。
(4)产品中的杂质除极少量H2O外,最有可能含的是 (填化学式)。
有一包粉末,已知由BaSO4、FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成.为了确定其成分,现进行以下实验,各步骤均已充分反应.
步骤一:取一定质量的粉末,加水搅拌后过滤,得到沉淀甲和无色溶液A;
步骤二:向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液;
步骤三:将步骤一得到的无色溶液A进行如图所示的实验.

请回答下列问题:
(1)白色沉淀B的化学式是 .
(2)无色溶液A中一定存在的溶质的化学式是 .
(3)这包粉末中一定含有物质的化学式是 .
(4)写出生成沉淀D的化学方程式 .
(5)写出步骤二中形成黄色溶液的化学方程式 .
有一包白色固体,可能含有碳酸钾、硫酸钠、氯化钠、硝酸钡、氢氧化钾中的一种或几种。某化学兴趣小组为探究其成分,进行如下实验:
(1)取少量固体于烧杯中,逐渐加水并不断搅拌,待烧杯中的物质充分反应后过滤,得到白色沉淀和滤液。
(2)取少量滤液于试管中,滴加酚酞溶液,酚酞溶液不变色。
(3)向白色沉淀中滴加过量稀硝酸并不断搅拌,沉淀部分溶解。
请根据上述实验过程和发生的现象,回答问题:
原白色固体中一定含有 ,一定不含有 ,可能含有 。
有一包固体粉末可能含有Na 2CO 3、FeCl 3、CaCl 2、NaOH中的一种或几种,为了探究它们的成分,进行如下实验:①取少量该固体粉末加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;②向滤液中滴加酚酞溶液,溶液变红.根据上述实验回答下列问题:
(1)粉末中一定不含 ,一定含有 .
(2)为了确定可能含有的物质,取少量②中红色溶液于试管中,加入过量的 溶液,若溶液仍为红色,则证明该物质一定存在.
下表是某研究性学习小组研究影响过氧化氢溶液分解速率的因素时采集的一组数据:
10毫升过氧化氢溶液取150毫升氧气所需的时间(秒)。
| 浓度 反应条件 |
30﹪的过氧化氢溶液 |
15﹪的过氧化氢溶液 |
10﹪的过氧化氢溶液 |
5﹪的过氧化氢溶液 |
| 无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
| 无催化剂、加热 |
360 |
480 |
540 |
720 |
| 二氧化锰作催化剂、加热 |
10 |
25 |
60 |
120 |
请你分析回答:
(1)该研究小组在设计方案时,考虑了浓度、 、 等因素对过氧化氢溶液分解速率的影响。
(2)从上述影响过氧化氢溶液分解速率的因素中任选一个,说明该因素对分解速率有何影响?
某实验小组用右图所示装置来测定空气中氧气的含量。
(1)实验结果发现测得数值比实际空气中氧气的含量小,请你帮助他们找出实验误差的原因。(写出两条即可)
(2)集气瓶水的作用是什么?
实验室配制50g质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足量的硝酸钾固体和水,请选用上述药品设计三种配制方案,并填入下表:
| |
配制方案(只要说明配制所需的各种药品及用量即可) |
| 方案一 |
|
| 方案二 |
|
| 方案三 |
|
碳酸钠与盐酸的反应是分两步进行的,第一步反应的化学方程式为:
.为验证该反应分两步进行.如图所示进行实验(装置气密性良好).

步骤
:用注射器1向小药瓶中緩慢注入一定量的稀盐酸,边注入边振蕩,细玻璃管中液柱略微升高;換注射器
从瓶中缓慢抽取气体,澄清石灰水不浑浊.
步骤
:…
(1)补充步骤
的实验操作和预期现象.
(2)说明细玻璃管在实验中的作用.
(3)实验后,将小药瓶、注时器
、注射器
中的所有物质依次倒入一个洁净的烧杯中,只得到无色溶液,向其中滴加酚酞溶液不变色.写出溶液中溶质成分存在的几种情况(酚酞省略不写).
在实验室小金分别用甲盐的晶体配置了溶质质量分数为5%的A溶液和30%的B溶液,但忘了贴标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液。请写出简要的实验方案和明确的判别依据。有下列仪器、物品供选择:量筒、天平、
小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜罗卜、甲盐的晶体。
(实验室的室温为30℃,30℃甲盐的溶解度为50g)
方案1:
判别依据:
方案2:
判别依据:
某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。学科王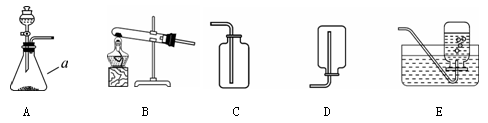
(1)写出仪器a的名称: 。
(2)甲同学从上图中选择A、E装置的组合制取氧气,该反应的化学方程式为: 。在用胶皮管连接装置A和E中的玻璃导管时,应先把玻璃管口 ,然后稍稍用力把玻璃管插入胶皮管。收集气体前,应将集气瓶装满 并盖上 。收集氧气还可选用的装置是 。
(3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。该反应的化学方程式为2KMnO4 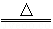 K2MnO4+MnO2+O2↑ 。实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究:
K2MnO4+MnO2+O2↑ 。实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究:
[提出猜想]猜想I:反应生成的MnO2分解放出O2;
猜想II:反应生成的K2MnO4分解放出O2;
猜想III:反应生成的K2MnO4和MnO2分解都放出O2。
[实验验证]同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,
则猜想 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择简单的实验方法是 。
[拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂 (选填“是”或“否”),为什么? 。
某同学设计了测定空气中氧气含量的实验,实验装置如图。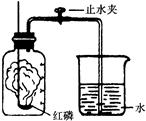
该同学的实验步骤如下:
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)该实验中红磷需稍过量,目的是 。
(2)步骤③中打开止水夹后观察到的现象是 ,由此可得出空气中氧气的体积分数约为 。
(3)该实验可推论出氮气__________(填“易”或“难”)溶于水和其化学性质________(填“活泼”或“不活泼”)的结论。
(4)若将红磷换成炭粉,该实验能否获得成功?为什么?
______________, 。