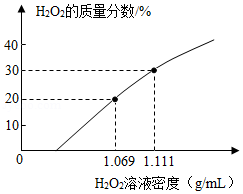
在新冠肺炎的疫情防控中,过氧化氢(H2O2)广泛用于环境消毒,在放置过程中会缓慢分解。某单位有一桶未曾使用过的久置的H2O2溶液,观测得其溶液密度为1.069g/mL,该温度下溶液的密度和溶质质量分数的对应关系如图。桶上标签提供的信息:①H2O2的质量分数为30%;②内装溶液质量50kg,完成下列问题:
(1)该久置的H2O2溶液的溶质质量分数为 。
(2)若用此久置的H2O2溶液来配制质量分数为3%的环境消毒液200kg,需用这种H2O2溶液 kg。
(3)若这桶H2O2溶液放置至完全分解,桶中剩下的液体质量是多少?(假设液体不挥发,通过计算回答,结果精确到0.1)
某化学兴趣小组同学做了实验后在整理实验室时,得到白色固体药品,查阅药品记录单可知,可能是碳酸钠、碳酸氢钠和硫酸钠中的两种物质的混合物。为探究其成分,进行如下探究活动:
[猜想与假设]针对其组成:
猜想一:含有Na2CO3和Na2SO4;
猜想二:含有Na2SO4和NaHCO3;
猜想三:含有 。
[实检探究]
实验Ⅰ:取白色固体于试管中加热,将产生的无色无味气体通入澄清石灰水,澄清石灰水变浑浊。
实验Ⅱ:取加热后的白色固体于试管中加足量的盐酸后,再滴加氯化钡溶液,立即产生白色沉淀。
[实验分析及结论]
(1)实验Ⅰ中,产生无色无味气体反应的化学方程式为 。实验Ⅱ中,滴加氯化钡溶液产生白色沉淀反应的化学方程式为 。
(2)实验Ⅰ中可判断猜想 不成立。
综合实验Ⅰ、Ⅱ,可判断猜想 不成立。
[拓展延伸]
若Na2SO4溶液中混有少量的NaHCO3,提纯Na2SO4溶液的实验方案是 。
如图是某化工企业利用“侯氏制碱法”生产纯碱的部分工艺流程示意图:
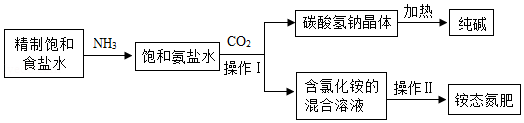
查阅资料知:①NH4Cl NH3↑+HCl↑;②氨气极易溶于水,氨水呈碱性。
(1)检验食盐水是否饱和的方法是 。
(2)操作Ⅰ的名称是 。实验室进行此操作时,玻璃棒的作用是 。
(3)“侯氏制碱法”中,向饱和氨盐水中通入足量的CO2,使氨气、水、NaCl和CO2反应生成NaHCO3等,该反应的化学方程式为 ;先通氨气形成饱和氨盐水,后加压通入二氧化碳,这样操作的目的是 。
(4)处理含氯化铵混合溶液时,不直接加热蒸干得到氯化铵固体的原因是 。
维生素C(化学式C6H8O6)对人体皮肤和牙龈健康有重要作用。缺乏维生素C会引起坏血病,中学生每天需要补充约60mg维生素C.请回答下列问题:
(1)维生素C由 种元素组成,它属于 (填“无机物”或“有机物”)。
(2)含2g氢元素的维生素C中,氧元素质量为 g;17.6g维生素C中含 g碳元素。
利用下列装置进行气体的制取实验,请问答下列问题:
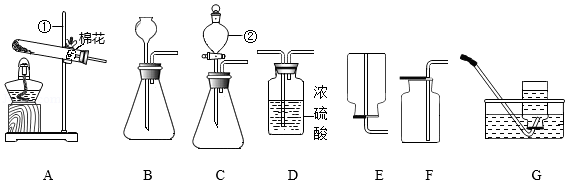
(1)写出仪器的名称:① ② 。
(2)实验室用过氧化氢溶液制取氧气时,若要制取一瓶干燥的氧气,必须使气体通过 (填字母,下同)装置,选用装置 收集,验满的方法是 。
(3)实验室用加热高锰酸钾固体的方法制取较纯净的氧气,选用发生装置 和收集装置G组合,检查该装置气密性的方法是:连接好仪器,把导管的一端浸入水中, ,证明装置连接完好、不漏气。
(4)实验室用电石固体与饱和食盐水常温下反应制取乙炔(C2H2)气体,同时有糊状 Ca(OH)2生成,发生装置选用C而不选用B的原因是 ;乙炔充分燃烧的化学方程式为 。
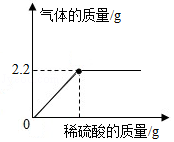
某纯碱样品中含有少量的氯化钠,某化学兴趣小组欲测定其中碳酸钠的质量分数。他们称取6.0g样品放入锥形瓶中,加入稀硫酸直到不再产生气体为止,反应中生成气体的质量与加入稀硫酸的质量关系如图所示:
计算:
(1)反应生成的二氧化碳的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数(写出计算过程,计算结果精确到0.1%)。
(反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+CO2↑+H2O)
“保宁醋”是“阆中三绝”之一,其中含有醋酸(CH3COOH)。
(1)醋酸中碳、氢元素的质量比为 (最简整数比)。
(2)90g醋酸中碳元素的质量为 g。
(1)如图为实验室制取并收集气体的装置图,回答下列问题。

①a仪器的名称是 。
②实验室用高锰酸钾制取并收集干燥的氧气应选用的装置组合是 (填序号)。
③若用F装置收集并测量氧气的体积,应在 (填“d”或“e”)端连接量筒。
④实验室制取二氧化碳的化学方程式是 ,用B装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在 (填“b”或“c”)处。
(2)某化学兴趣小组在学完金属活动性顺序相关知识后,他们做了钠与硫酸铜溶液反应的实验,发现并没有铜生成,而是产生蓝色絮状沉淀和少量黑色物质。于是他们进行了如下探究:
[实验探究1]取一块绿豆大小的金属钠,放入盛有20mL蒸馏水的烧杯中,发现金属钠浮在水面上,熔化成一个闪亮的小球并四处游动,发出嘶嘶的响声,收集反应产生的气体,发现该气体能燃烧。
[实验探究2]在上述反应所得溶液中滴加硫酸铜溶液,产生蓝色絮状沉淀。
[实验探究3]将蓝色絮状沉淀加热得到黑色固体。
[查阅资料]①钠在常温下能与水剧烈反应,生成一种碱和一种气体。②氢氧化铜受热易分解。③氧化铜为黑色固体。
[问题分析]①写出钠与水反应的化学方程式 ,点燃反应产生的气体前应该先 。②写出产生蓝色絮状沉淀的化学方程式 。
[实验结论]在金属活动性顺序中,活动性较强的金属 (填“一定”或“不一定”)能将位于其后面的金属从它们的盐溶液中置换出来。
[反思与交流]钠与硫酸铜溶液反应产生少量黑色物质的可能原因是 。
阅读下面科普短文
人类目前所消耗的能量主要来自化石能源,化石燃料是由古代生物的遗骸经过一系列复杂变化形成的。化石燃料燃烧时产生的一些物质,如一氧化碳、二氧化硫、未燃烧的碳氢化合物及炭粒、氮的氧化物等排放到空气中,会对空气造成污染。二氧化硫和氮的氧化物在空气中发生反应后的生成物溶于雨水,会形成酸雨。
天然气是一种重要的化石能源,主要含有由碳和氢组成的气态碳氢化合物,其中最主要的是甲烷。不同地区天然气的主要成分有较大差异,我国部分地区天然气的主要成分如下表所示:
CH4 |
C2H6 |
C3H8 |
CO2 |
N2 |
H2S |
|
西南油田 |
93.1098 |
3.8914 |
0.1447 |
1.3092 |
0.5341 |
﹣ |
华北油田 |
80.8430 |
9.7326 |
5.7538 |
0.9288 |
0.3200 |
﹣ |
陕甘宁油田 |
95.9500 |
0.9675 |
0.1367 |
1.5038 |
﹣ |
0.0002 |
注:1.表中数据均表示体积分数。2.“﹣”表示含量过低,当前所用仪器未检出。
天然气的用途非常广泛,可作为燃料直接使用。天然气在不同设备中燃烧产生的污染物的含量也不尽相同,几种常见设备中天然气燃烧时产生的污染物(kg/Mm3)如图所示:
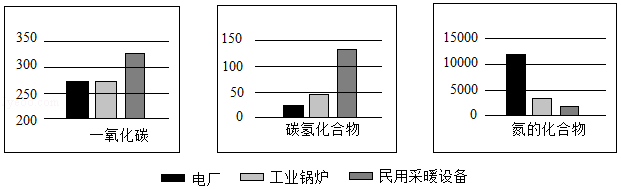
现代社会对能量的需求量越来越大,化石能源日渐枯竭,人们正在利用和开发其他能源。这些能源的利用,可以部分解决化石能源面临耗尽的问题,并在一定程度上减少了对环境的污染。
依据文章内容,回答下列问题。
(1)化石燃料是 (填“可再生”或“不可再生”)能源,主要包括 、 和天然气。
(2) 油田的天然气中丙烷(C3H8)含量最高,写出丙烷完全燃烧的化学方程式 。
(3)氮的氧化物排放到空气中可形成酸雨,酸雨是pH< 的降雨。
(4)在电厂、工业锅炉和民用采暖设备中天然气燃烧效率最低的是 。
A.电厂 B.工业锅炉 C.民用采暖设备
(5)甲烷除用作燃料外,在工业上也有重要的用途。科学家探索出在一定条件下用甲烷为原料制成了金刚石,写出该反应的化学方程式 。
金属与人类生活密切相关,回答下列问题。
(1)铯原子钟300年误差不超过5秒。铯元素在元素周期表中的信息如图所示,则铯的相对原子质量是 。
(2)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:纯铜 黄铜(填“>”、“<”或“=”)。
(3)金属资源储量有限,而且不可再生。下列措施能够减缓金属消耗速度的是 。
A.回收利用废旧金属
B.加大对金属矿物的开采,提高金属产量
C.寻找和开发金属的替代品
D.提高金属制品的的防腐能力,延长金属制品的使用寿命
(4)铁是目前世界年产量最高的金属,但易生锈,写出用稀盐酸除铁锈的化学方程式 。
(5)往硝酸银溶液中加入一定量的锌和铜的混合物,充分反应后,过滤,滤液为蓝色,则滤液中一定含有的金属离子是 。

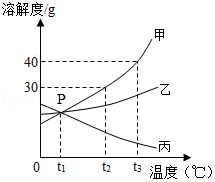
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
某袋装食品的脱氧剂由活性炭、铁粉和食盐混合而成,三者质量比为2:2:1.现用该脱氧剂进行实验,回答下列问题:
(1)将该脱氧剂加入盐酸中,发生反应的化学方程式为 。
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是 (填化学式)。5.0g未经使用的该脱氧剂最多能够吸收氧气 g。
(3)用电子秤称取7.20g完全失效后的脱氧剂放入烧杯中,加入足量稀硝酸,充分溶解后过滤,滤渣为黑色粉末。向所得滤液中加入足量AgNO3溶液,充分反应产生的沉淀质量为2.87g。列式计算该失效脱氧剂中NaCl的质量分数(计算结果精确到0.1%)。
某化学兴趣小组利用“化学喷泉”设计了如下实验:20℃时,用250mL圆底烧瓶收集一瓶纯净的CO2,按如图组装装置。用注射器缓缓注入3mL NaOH溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E装置中发生连锁反应。回答下列问题:

(1)图中仪器X的名称是 。
(2)注入NaOH溶液后,烧瓶内发生反应的化学方程式是 。
(3)“连锁反应”后,C试管中溶液的颜色变化为 ;E试管中的现象为 ,反应的化学方程式为 。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有NaOH剩余,你认为是否正确? ,说明原因: 。
文宏同学利用“金属树”趣味实验来验证Zn、Cu、Ag三种金属的活动性顺序。
(1)为确保实验效果,CuCl2溶液和AgNO3溶液需现配。配制50g质量分数为12%的CuCl2溶液,应称量 g CuCl2,加水时应选用 mL的量筒。除量筒外,配制溶液还需要的玻璃仪器有 。
(2)向两个放有宣纸的培养皿中分别滴入适量CuCl2溶液、AgNO3溶液,再放入锌粒,一段时间后观察到的实验现象如图。
①形成“铜树”时发生反应的化学方程式是 。
②仅用“铜树”和“银树”实验尚不能验证 的金属活动性顺序,需补充一个实验来证明,应选用的药品是 (可供选择的药品有:锌粒、铜丝、银丝、稀盐酸、CuCl2溶液、AgNO3溶液)。
