化学兴趣小组对贝壳中碳酸钙的含量进行探究。
【提出问题】
如何选择药品和设计装置进行测定?
【查阅资料】
贝壳的主要成分是CaCO3,其它成分对实验影响忽略不计。
室温时,CaCO3不溶于水,CaSO4微溶于水。
【设计与实验】
实验一:选择药品
分别取等质量颗粒状和粉末状的贝壳样品与等体积、等浓度的稀盐酸在图1的三颈烧瓶中反应,采集数据。
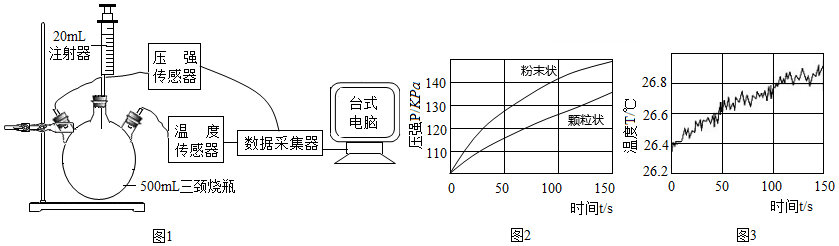
(1)图1中反应的化学方程式是 。
(2)据图2分析,选择粉末状样品的依据是 。
(3)据图3分析,影响实验测定准确性的原因:一是水蒸气含量增加;二是 。
实验二:设计装置

小组设计了图4装置进行测定。
(4)打开活塞,稀硫酸进入试管,观察到的现象是 。反应结束后进行读数。读数前调节水准管与量气管液面相平的原因是 。
实验三:优化装置
在老师指导下,小组优化并设计了图5装置进行测定。
(5)试剂a是 。
(6)检查该装置气密性的方法是 。
(7)加入足量稀硫酸,一段时间后反应停止。再加入氯化铵溶液,发现又产生气泡。推测加入氯化铵溶液的作用是 。
【数据处理】
(8)实验三中,样品质量为mg,加入稀硫酸体积为V1mL,加入氯化铵溶液体积为V2mL,右侧针筒最后读数为V3mL,则反应生成CO2体积为 mL.该实验条件下,CO2密度为dg/mL,则该样品中碳酸钙质量分数表达式为 。
【反思与评价】(9)与实验二相比,实验三的优点是 (写一条)。
回答下列问题。
(1)从硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如图:
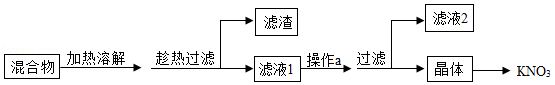
①结合如表分析,趁热过滤的原因是 。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
|
②操作a的名称是 。
③滤液2的溶质是 。
(2)A~D为初中化学常见物质,A、D为金属,在常温下通过如图所示转化可获取硝酸钾。回答下列问题。
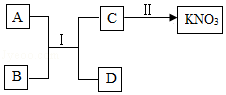
①反应Ⅰ能发生的原因是 。
②若D为银白色贵重金属,则反应i的化学方程式是 ,基本反应类型是 。
③一步实现反应Ⅱ,能否加入氯化钾?判断并说明理由 。
④硝酸钾可作化肥,能供给作物两种养分,属于 肥料。
配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题。
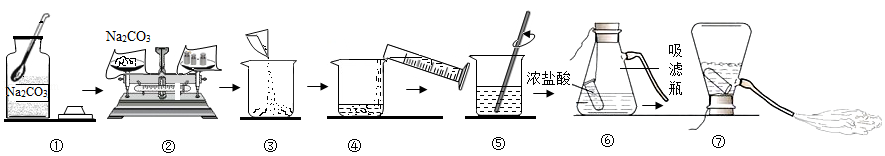
(1)计算Na2CO3的质量为 g,称量Na2CO3的仪器名称是 。
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液 (填“是”或“不是”)该物质的饱和溶液。
(3)将烧杯中溶液倒入吸滤瓶的操作是 ,从橡胶管喷出大量液体的原因是 。
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是 。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是 。用干粉灭火器灭火的正确操作顺序是 → → (填序号)。
同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)。
实验次数 |
1 |
2 |
3 |
4 |
加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
烧杯中剩余物质的质量/g |
25.2 |
m |
63.8 |
83.8 |
(1)表格中m的值为 。
(2)样品中Na2CO3的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
“84消毒液”是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)“84消毒液”中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌“84消毒液”进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
浓度(mg/m3) |
对人体的影响 |
3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O)
随着手机、电脑等移动设备的普及,人们对充电设备的要求越来越高。最近,某品牌氮化镓充电设备以体积小、功率大深受消费者喜爱。
(1)氮化镓(GaN)是充电设备中的核心材料。查阅资料得知:氮化镓中氮元素的化合价与氨气(NH3)中氮元素的化合价相同。由此可知,氮化镓中镓元素的化合价为 。
(2)氮化镓的制取可通过镓与氨气在高温下发生置换反应来实现,其反应的化学方程式为 。
“84消毒液”是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)“84消毒液”中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌“84消毒液”进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
浓度(mg/m3) |
对人体的影响 |
3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O)
随着手机、电脑等移动设备的普及,人们对充电设备的要求越来越高。最近,某品牌氮化镓充电设备以体积小、功率大深受消费者喜爱。
(1)氮化镓(GaN)是充电设备中的核心材料。查阅资料得知:氮化镓中氮元素的化合价与氨气(NH3)中氮元素的化合价相同。由此可知,氮化镓中镓元素的化合价为 。
(2)氮化镓的制取可通过镓与氨气在高温下发生置换反应来实现,其反应的化学方程式为 。
工业纯碱中含少量氯化钠。兴趣小组分别采用不同的方法测定工业纯碱样品中碳酸钠的质量分数。
(1)方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用 。
(2)方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。
(Na2CO3+CaCl2═CaCO3↓+2NaCl)
烧杯1 |
烧杯2 |
烧杯3 |
|
样品溶液(克) |
10 |
20 |
30 |
氯化钙溶液(克) |
30 |
30 |
30 |
沉淀质量(克) |
2 |
4 |
5 |
(3)请写出提高方法一测量精确度的操作建议(写出2条) 。

小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如图:
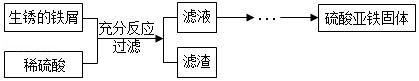
资料:①Fe2(SO4)3+Fe═3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸 克。
(2)写出该实验中的一条化学方程式(除资料①中的反应外) 。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是 。
新冠疫情发生以来,在“坚定信心、同舟共济、科学防治、精准施策”的思想指引下,中国抗疫取得重大胜利!
(1)对新型冠状病毒的毒株分离和基因测序,是研发疫苗和药物的基础。为应对疫情,同学们都居家学习,在此期间做法合理的有 。
A.健康饮食,平衡膳食
B.长时间躺床上看书
C.多服用抗生素增强抵抗力
D.关爱家人,乐观面对生活
(2)佩戴口罩出行是预防新冠肺炎的重要举措。一次性口罩需要及时更换,废弃的口罩应放入 垃圾桶最合适。
(3)对公共场所的定期消毒是控制新冠肺炎的有力保障。“84”消毒液被广泛用于新冠疫情的卫生消毒,可通过氯气与氢氧化钠反应制取,生成物中有氯化钠、次氯酸钠(NaClO) 和水,其中次氯酸钠是消毒液的有效成分。
①次氯酸钠中氯元素的化合价为 。
②写出制取“84”消毒液的化学方程式 。

将12.9克NaCl和Na2CO3固体混合物完全溶于水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。
实验序号 |
1 |
2 |
3 |
4 |
5 |
加入CaCl2溶液质量/克 |
15 |
15 |
15 |
15 |
15 |
生成沉淀的总质量/克 |
3 |
m |
9 |
10 |
10 |
求:(1)表格中m的数值是 。
(2)溶液中Na2CO3完全反应是在第 次实验。
(3)固体混合物中Na2CO3的质量分数。(精确到0.1%)
(4)请画出上述过程溶液中NaCl质量的变化图。
2019年诺贝尔化学奖用于表彰锂离子电池的研发。这种质量轻、可充电、功能强大的电池现在被广泛应用于手机、笔记本电脑和电动汽车等各种产品。

(1)锂电池充电时,电能转化为 能。
(2)碳酸二甲酯(C3H6O3)是锂电池电解液的一种成分,下列关于碳酸二甲酯说法正确的有 。
A.由C、H、O三种元素组成
B.碳元素的质量分数最大
C.相对分子质量是90克
D.分子中C、H、O三种原子的个数比为1:2:1
(3)图为某款锂电池手机在不同温度下的电压随时间变化的图象,请结合图象分析手机夏天比冬天耐用的原因是: 。
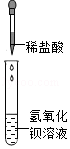
做酸碱实验时,小敏将稀盐酸逐滴加到氢氧化钡溶液中(如图),发现一直无明显现象,突然想起忘记加无色酚酞试液。为探究反应的进程,过程如下:(已知BaCl2溶液呈中性)
【建立猜想】①氢氧化钡过量 ②盐酸过量
【实验设计】
步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
实验方案 |
实验操作 |
实验现象 |
实验结论 |
Ⅰ |
重新取样,滴加少量AgNO3溶液 |
白色沉淀 |
猜想②正确 |
Ⅱ |
重新取样,滴加足量Na2CO3溶液 |
|
猜想②正确 |
白色沉淀 |
猜想③正确 |
(1)对方案Ⅰ的结论进行评价: 。
(2)表格空白处的实验现象是: 。
【表达交流】为确定猜想②是否正确,还可以选择的试剂有 。
A.紫色石蕊试液 B.铜片 C.铁锈