某同学为了测定
和
固体混合物中
的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的
溶液,获得如下实验数据:
| 实验次数 |
一 |
二 |
三 |
四 |
| 固体混合物的质量(g) |
20 |
20 |
20 |
20 |
| 加入
溶液的质量(g) |
20 |
40 |
60 |
80 |
| 生成沉淀的质量(g) |
2.9 |
m |
8.7 |
8.7 |
问:
A.表中m的值为;
B.原固体混合物中
的质量分数是多少?(要求写出计算过程)
“黄铜”即铜锌合金,古代称为“俞石”。由于外观酷似黄金,常被不法商贩冒充黄金出售。某实验小组为了辨别其真伪,用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
| |
第一次 |
第二次 |
第三次 |
| 所取合金的质量/g |
25 |
25 |
50 |
| 所用稀硫酸的质量/g |
120 |
160 |
100 |
| 充分反应后,剩余物总之量/g |
144.6 |
184.6 |
149.6 |
(1)根据上表数据分析所取合金与稀硫酸的质量比为 时,合金中的锌与稀硫酸中的硫酸恰好完全反应。
(2)计算铜锌合金中的铜的质量分数。
(3)计算恰好完全反应后所得溶液中的溶质的质量分数。
实验室的药品回收桶内有6g固体药品,是由Na2CO3和Na2SO4组成的混合物,现在向其中滴加稀硫酸至不再产生气泡为止,共消耗稀硫酸50g,将产生的气体全部通入足量氢氧化钠溶液中,氢氧化钠溶液增重2.2g。
(1)求原混合物中硫酸钠的质量。
(2)求硫酸中溶质的质量分数。
现有含少量硝酸钡杂质的固体氯化钡样品,取12.5 g样品放入烧杯中,然后加入37.5 g水使其完全溶解。取10 g溶液,加入100 g硝酸银溶液,恰好完全反应生成白色沉淀,过滤后得到107.13 g的滤液,试计算:
(1)样品中氯化钡的质量 (2)107.13 g滤液的溶质质量分数
生活中处处有化学,小明把学到的化学知识用于生活中,进行下列探究。
(1)如图所示,小明把一只新鲜鸡蛋放入盛水的玻璃杯中,鸡蛋沉入水底(蛋壳的主要成分是碳酸钙)。若向玻璃杯中逐渐滴加浓盐酸,鸡蛋壳表面将出现的现象是 ,相应的化学反应方程式为 。
(2)小明同学在家里做了如图所示的小实验。
①图Ⅰ中观察到的主要现象是鸡蛋壳表面有气泡产生,蜡烛火焰熄灭。由此得出有关CO2性质的结论是 、
。并依此性质确定CO2的一个主要用途是 。
②当蜡烛熄灭后,在玻璃杯口迅速盖—块蘸有石灰水的玻璃片(见图Ⅱ)。观察到的现象是玻璃片上的石灰水 ,此现象说明在杯中有 气体产生,写出气体与石灰水反应的化学方程式 。
(3)小明把含碳酸钙85%的鸡蛋壳20g和足量的稀盐酸反应,计算产生的气体是多少克?
国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
某同学将一定质量的锌粒放入
稀硫酸溶液中,恰好完全反应,并产生了
氢气。
计算:(1)参加反应的锌的质量。
(2)所用稀硫酸溶液中溶质的质量分数。
碳酸钙是牙膏中一种常用的摩擦剂,可用石灰水作原料来制备,某工厂为了测定一批石灰石中所含碳酸钙的质量分数,称取1000
石灰石中样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,冷却,称量剩余固体的质量为648
.已知反应的化学方程式为:
↑,样品中的杂质不参加反应,据此计算:
(1)生成二氧化碳的质量.
(2)石灰石样品中碳酸钙的质量分数.
实验室欲配制100g溶质质量分数为10%的氯化钠溶液。配制步骤为:
(1)需氯化钠固体和水的质量各多少克?
(2)量取水最好选择_______的量筒(填序号①10mL②50mL③100mL)(水的密度为1g/cm3)。
(3)将氯化钠固体溶于水,用 搅拌,使氯化钠全部溶解,冷却至室温,装瓶储存。
(4)若将100g溶质质量分数为10%的氯化钠溶液稀释成5%的溶液,需要加水的质量多少g?
取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的
溶液,产生沉淀质量与滴入
溶液质量的关系如图所示。
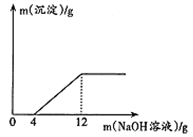
(1)滴入
溶液的质量在0~4g时,发生反应的化学方程式为;
(2)与氯化铜反应的
的质量为g;
(3)原盐酸与氯化铜的混合溶液中氯化铜的质量分数(写出计算过程).
某补钙药剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与40盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6
,请回答下列问题(计算请写出过程):

(1)青少年缺钙易出现的疾病是;
(2)该品牌补钙药剂每片含
的质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)
为了验证质量守恒定律,在两个小试管中分别注入20g4.9%稀硫酸和20g氯化钡溶液,放于一个大烧杯中称量,如图所示
试根据要求,回答下列问题:(1)将两只小试管内药品充分混合后,写出观察到的一项实验现象: 。
(2)混合后,反应结束后,整个装置的质量与之前相此较_______(填写下列各项的序号)。①没有变化 ②有变化,后者质量变小 ③有变化,后者质量变大 ④不能确定
(3)若稀硫酸完全反应,试通过计算,求此时所得不饱和溶液的质量。(写出相应计算过程,计算结果精确至0.01g)
将100g碳酸钠溶液和144g氯化钙溶液混合,恰好完全反应,过滤,得滤液的质量234g。求:(1)反应后生成沉淀的质量为 g。(2)过滤所得溶液中溶质的质量分数。(结果保留到整数位)
请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),完成下列问题:

(1)该反应产生的
气体质量为g。
(2)计算反应后所得溶液中溶质质量分数(写出计算过程)
黄铜是一种常见的合金材料,其作用成分为
、
,还含有少量不与酸反应的成分.现向一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生
的质量和硫酸溶液体积的关系如图所示.充分反应后溶液中剩余固体的质量为27g。

(1)观察图象,黄铜与硫酸充分反应后,硫酸是否有剩余?(选填"是"或"否")
(2)黄铜中
的质量分数为多少?(请列式计算,结果精确到0.1%)
(3)若往反应后的溶液中滴加26%的
溶液至恰好不再产生沉淀时,共消耗
溶液400g,则原硫酸溶液的质量分数为多少?(请列式计算,结果精确到0.1%)