普通黄铜由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件等。为了测定某黄铜样品中铜的含量,设计了如下实验方案。
取50.00g黄铜样品,加入一种未知浓度的稀盐酸。有关实验数据如下图。
(1)样品完全反应产生H2的质量___________。
(2)图中m与n的关系是m n(填“>”、“<”或“﹦”)。
(3)黄铜样品中铜的质量分数是多少(写出计算过程,保留小数点后一位)。
(4)某同学根据图中数据计算盐酸的质量分数为:
请分析该同学的计算结果是否正确,如不正确指出错误的原因。
。
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
| 加入稀盐酸质量(g) |
10 |
10 |
10 |
10 |
| 剩余固体的质量(g) |
9.10 |
8.45 |
7.80 |
7.80 |
(1)上述反应的化学方程式为 ;
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式
;
(3)所用稀盐酸中溶质的质量分数为多少?
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为多少?
(5)黄铜样品中铜的质量分数为多少?
人类的生产和生活都离不开金属。
Ⅰ.金属元素在自然界中分布很广,在地壳中主要以矿物形式存在。下列矿石的主要成分不属于氧化物的是 (填序号)。
Ⅱ.铁是应用最广泛的金属。
(1)下图是工业炼铁示意图。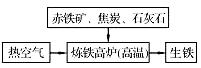
其中,焦炭的作用是燃烧提供能量和 ;
写出有铁生成的化学方程式 。
(2)某兴趣小组在实验室中模拟炼铁的化学原理,用一氧化碳还原纯净的氧化铁粉末,实验装置如图。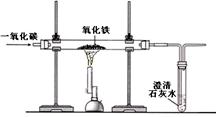
①实验中玻璃管里固体粉末的颜色变化是 ,澄清的石灰水中发生反应的化学方程式是 。
②该装置有何不妥? 。
(3)该化学兴趣小组的同学利用改正后的装置进行探究用500g含氧化铁质量分数为70%的赤铁矿,可以炼出含杂质4%的生铁多少克?
某化学兴趣小组想对某次高炉炼铁得到的生铁中铁的质量分数进行探究,请按要求完成下列探究报告。
【实验目的】测定生铁中铁的质量分数。
【资料支撑】
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素。碳在生铁中以两种形态存在:一种是单质碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
【实验过程】
①取一只烧杯,称得其质量为70.4g,加入一定量生铁的样品碎屑,称得烧杯和样品的总质量为102.4g;
②向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少
量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
③静置,称量。称得烧杯和剩余物质的总质量为348.7g。
【数据处理】计算该生铁样品中单质铁的质量分数是多少?(写出计算过程)
【交流讨论】
(1)实验过程中稀硫酸要过量的原因是:_____________________________________;
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%。假设没有与稀硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量为________(计算结果保留一位小数);
(3)该小组的同学还查阅到:一氧化碳具有可燃性,点燃一氧化碳与空气的混合物有可能爆炸。
由此我们得到启示:在点燃或加热一氧化碳前,一定要先_________;
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓

(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为 g.
(2)计算MgSO4溶液中溶质的质量分数(列式计算).
5g溶质质量分数为7.3%的稀盐酸滴入盛有10g氢氧化钠溶液(滴有2滴酚酞试液)的烧杯中,恰好完全反应时消耗此稀盐酸的质量为5g,回答并计算:
(1)恰好完全反应时的现象是 。
(2)求此NaOH溶液中溶质的质量。
(3)求所得溶液中溶质的质量分数(酚酞试液质量不计)。
锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。已知葡萄糖酸锌的化学式为C12H22O14Zn(相对分子质量为455)。请回答:
(1)葡萄糖酸锌是由___________种元素组成的。
(2)葡萄糖酸锌中所含锌元素的质量分数为__________(结果保留至0.1%)。
(3)现有一支20mL的葡萄糖酸锌口服液,其中含锌6.5mg,那么该口服液中葡萄糖酸锌的质量是_________ mg。
(11分) 向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?
为了分析生铁中铁的含量,某学习小组进行了实验研究,即取6g生铁与10%的盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图(见右下图)。
说明:生铁中杂质不溶于水,不与盐酸反应。
(1)铁完全反应用去盐酸的质量为 g。
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)某同学列出了如下计算式:
生铁与盐酸刚好反应完全时所得溶液质量= (73+6-a)g小明对该计算式提出了质疑,请指出其中的错误 。
右图是两种化肥标签的一部分,请回答:
(1)从标签上看,两种化肥具有共同的物理性质之一是 ;碳酸氢铵不同于尿素的化学性质是 。
(2)尿素的相对分子质量为
(3)从含氮量角度,50kg这种碳酸氢铵相当于 kg(精确到0.1)这种尿素。
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。
第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的稀盐酸,反应产生气体的变化如下图所示:
请根据实验步骤和图像进行分析与计算:
(1)20g试剂与稀盐酸完全反应产生二氧化碳的质量为 g。
(2)计算该20g试剂中含有NaOH的质量分数(结果精确到0.1%)。
(3)如果第二步中改为向第一步配制成溶液中加入足量的澄清石灰水,则生成沉淀的质量为 g。
(4)如果实验测得该瓶试剂中的Na2CO3的质量分数为A,但氢氧化钠的质量分数 却小于(1—A),请你分析可能原因是 。
2010年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
(1)表中X的值为 ;
(2)碳酸钙恰好完全反应时消耗稀盐酸 g;
(3)求样品中碳酸钙的质量分数为多少?
课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。
【粗产品制备】
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为 。
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。
【粗产品成分分析】
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,该反应的化学方程式为 ,由此该粗产品中一定不含有 。
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质。
【含量测定】Na2CO3含量的测定
(1)该兴趣小组的同学设计了下图所示的实验装置。取20.0g粗产品,进行实验。
【说明】①碱石灰是CaO与NaOH的固体混合物。
②CO2在饱和NaHCO3溶液中的溶解度非常小。
(2)操作步骤:
①连接好装置,检查气密性;将药品加入各装置
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为0.48g。
(3)问题探究:
①在用托盘天平称量粗产品时,如果天平的指针向右偏转,说明 。
②B装置的作用是 。
③在步骤②中,A处缓缓通入一段时间空气的目的是 。
④若没有H装置,则测定的Na2CO3的质量分数会 (填“偏大”、“偏小”、“不变”)。
⑤该兴趣小组指导老师认为该方案有些不合理,指导同学们更换了其中的一种试剂并去掉了一个装置后实验得到了完善,并测得20.0 g粗产品只能产生0.44 g CO2。你认为更换后的试剂是 ,原实验中实验值0.48g比正确值0.44 g偏大的原因是(假设操作均正确) 。(4)数据计算:
根据正确值0.44 g,求得粗产品中Na2CO3的质量分数是 (写出计算过程)。
“黄铜”即铜锌合金,古代称为“俞石”。由于外观酷似黄金,常被不法商贩冒充黄金出售。某实验小组为了辨别真伪,用该合金与稀盐酸反应,将三次实验所得相关的数据记录如下:
| 物质质量 |
第1次 |
第2次 |
第3次 |
| 所取合金的质量/g |
25 |
25 |
50 |
| 所用稀盐酸的质量/g |
120 |
160 |
100 |
| 充分反应后,剩余物总质量/g |
144.6 |
184.6 |
149.6 |
(1)根据上表数据分析,合金中的锌与稀盐酸恰好完全反应时,所取合金与稀盐酸的质量比为 ,生成气体的质量为 ;
(2)计算铜锌合金中的铜的质量分数;
(3)计算恰好完全反应后所得溶液中溶质的质量分数(得数保留一位小数)。
有两种外观类似黄金的①Cu—Zn合金和②Cu—Ag合金制品,若实验室只提供一瓶稀硫酸和必要仪器。
(1)你认为能测出合金 (填序号)中铜的质量分数;
(2)取上述(1)中的合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物的质量为69.8g。
求:①产生氢气的质量;
②求出该合金中铜的质量分数。