将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是()
| A. |
|
B. |
|
| C. |
|
D. |
|
下图是甲、乙两种固体物质的溶解度曲线。下列说法错误的是

| A. | 时,甲、乙两物质的溶解度相等 |
| B. | 乙的饱和溶液降温时,溶质质量分数保持不变 |
| C. | 甲中混有少量乙,可采用降温结晶的方法提纯甲 |
| D. | 时,甲的饱和溶液溶质质量分数为20% |
关于溶液的说法正确的是
| A. | 溶液都是无色透明的 | B. | 水可以溶解任何物质 |
| C. | 均一,稳定的液体都是溶液 | D. | 饱和溶液不一定是浓溶液 |
下列是"一定溶质质量分数的氯化钠溶液的配制"的实验操作示意图,其中错误的是
| A. |
取用氯化钠固体 |
B. |
.称量氯化钠固体 |
C. |
量取水的体积 |
D. |
溶解 |
的硼酸溶液可用于清洗皮肤的小面积创伤。现配制
质量分数为
的硼酸溶液,实验操作如下:
(1)称量硼酸固体的质量:在下图中分别标出所选砝码的质量和游码的示数。

(2)量取水的体积:用量筒取 水( )。
(3)溶解:用到的玻璃仪器是。
(4)装瓶、贴标签:在下图的标签中填上相应的内容。

硝酸钾溶解度随温度变化的曲线如图所示:

(1)图中
三点中属于不饱和溶液的是。
(2)由
点到
点可采取的措施。
(3)若
溶液中混有少量的
杂质,可以采取方法获得较纯净的
.
(4)若将
点溶液逐渐加水稀释使其质量分数降至10%,在此稀释过程中符合此溶液中溶质质量变化的规律的图像是。

为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;
(2)发生反应的化学方程式为;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为;
(4)该黄铜样品中铜的质量分数是;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是,再经过某些反应及操作就得到了所需铜盐。
运用溶解度表与溶解度曲线回答下列问题:
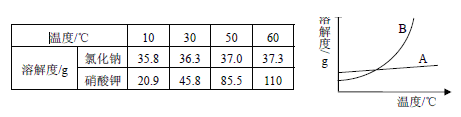
(1)氯化钠的溶解度曲线是(填"
"或"
")。
(2)
时,100
水中加入90
硝酸钾,充分溶解,所得溶液是(填"饱和"或"不饱和")溶液。当
的该溶液降温到
时,析出晶体的质量为
。
要配制100 5%的 溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是
| A. | 烧杯、试管、玻璃棒 | B. | 烧杯、胶头滴管、玻璃棒 |
| C. | 烧杯、胶头滴管、漏斗 | D. | 烧杯、酒精灯、玻璃棒 |
下图是恒温下模拟海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是()

| A. | 甲 | B. | 甲和乙 | C. | 乙和丁 | D. | 丁 |
在实验室小金分别用甲盐的晶体配置了溶质质量分数为5%的A溶液和30%的B溶液,但忘了贴标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液。请写出简要的实验方案和明确的判别依据。有下列仪器、物品供选择:量筒、天平、
小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜罗卜、甲盐的晶体。
(实验室的室温为30℃,30℃甲盐的溶解度为50g)
方案1:
判别依据:
方案2:
判别依据:
现有硫酸钠和硫酸镁固体混合物8 g,向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到2.9g沉淀和溶质质量分数为10 %的滤液。求:
(1)混合物中硫酸镁的质量分数;
(2)加入氢氧化钠溶液的溶质质量分数(计算结果精确到0.1%(。
实验室常配制一定溶质质量分数的溶液进行试验。
(1)配制溶液时溶解过程中用到玻璃棒,则玻璃棒的作用是________________。
(2)用量筒量取水配制溶液时,小明同学仰视读数,则所得溶液的溶质质量分数____(偏大、偏小、不变)。
(3)实验室所用氯化钠中含有不溶性杂质,在配制溶液前先进行氯化钠的提纯。则粗盐提纯的操作步骤有溶解、过滤、________、计算产率。小亮称取10g粗盐,经提纯后恰好配制成1000g溶质质量分数为0.9%的生理盐水。则在提纯的过程中产率为__________。
(4)配置好的溶液一般需要装入________备用,并贴上相应的标签。
如图所示,在室温下的饱和食盐水中放了一个塑料小球。
(1)现加入少量食盐晶体,充分搅拌和静止后,在温度不变的情况下,小球在液面沉浮情况有何变化 。
(2)若要在不用外力的情况下使小球略上浮,你准备采取的具体方法是 或 。