向100克溶质质量分数为20%的硝酸钾溶液中加入100克水,所得溶液中溶质质量分数是( )
| A.5% | B.10% | C.20% | D.40% |
t℃时,在饱和硫酸铜溶液中加入a g无水硫酸铜,恢复至原温度可析出b g硫酸铜晶体。说法正确的是
| A.溶液中溶剂的量不变,颜色不变 |
| B.b g硫酸铜晶体中含硫酸铜的质量大于a g |
| C.溶质质量分数不变,溶解度变小 |
| D.(b-a)g表示原溶液损失的溶质质量 |
泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液的溶质质量分数偏小的是
①称量好的食盐倒入烧杯时,有少许洒出 ②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的 ④用4g食盐和100g水配制溶液.
| A.②③ | B.①③④ | C.①②③ | D.①②③④ |
如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是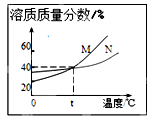
| A.M、N两溶液的溶质质量分数相等 |
| B.只有N析出晶体 |
| C.M、N均有晶体析出 |
| D.M、N两溶液都是饱和溶液。 |
下列有关溶液的认识中,错误的是
| A.析出晶体后的溶液是该温度下的饱和溶液 |
| B.在溶液里进行的化学反应,通常是比较快的 |
| C.同种溶质的饱和溶液,一定比它的不饱和溶液的浓度大 |
| D.食物里的营养成分经消化变成溶液,容易被人体吸收 |
如右图所示,20℃时100g硫酸铜饱和溶液中,分别加入下列物质后,相关分析错误的是
| A.溶质质量:Ⅰ=Ⅲ>Ⅱ | B.溶剂质量:Ⅰ>Ⅲ>Ⅱ |
| C.溶液质量:Ⅰ>Ⅱ=Ⅲ | D.溶质质量分数:Ⅰ<Ⅱ=Ⅲ |
将200g溶质质量分数为10%的蔗糖溶液,蒸发水变成溶质质量分数为20%的蔗糖溶液,需蒸发水的质量为
| A.90g | B.150g | C.100g | D.80g |
对“10%的食盐水”含义解释不合理的是
| A.100g食盐水中溶解了10g氯化钠 |
| B.将氯化钠与水按10:90的质量比配成的溶液 |
| C.100g水中溶解了10g氯化钠 |
| D.将20g氯化钠溶解在180g水中所得的溶液 |
下列化学实验中能达到预期实验结果的是
| A.借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25% |
| B.用pH试纸测定某未知溶液的pH为5.5 |
| C.20℃时,配制2%的氢氧化钙溶液 |
| D.将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20% |
下列有关“配置50g溶质质量分数为6%的氯化钠溶液”的操作错误的是
| A.使用托盘天平前,要先取下支撑托盘的垫圈,再调节天平平衡 |
| B.称取氯化钠前,要在天平两端的托盘上分别放质量相同的纸片 |
| C.移动游码使其右侧对齐3g的刻度线,然后将氯化钠加到天平的左盘上 |
| D.取用规格为50ml的量筒量取47ml水,快到所需刻度时改用胶头滴管定容 |
用氯化钠固体配制50g质量分数为5%氯化钠溶液,下列仪器中需要用到的是
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
 |
 |
 |
 |
 |
 |
 |
A.②④⑥⑦ B.①④⑤⑥ C.①③⑤⑦ D.①③④⑥
下列有关溶液的叙述,正确的是
| A.某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小 |
| B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大 |
| C.任何物质的饱和溶液,当温度降低时一定会析出溶质 |
| D.饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小 |
在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是
①用量筒量取水时俯视读数
②配制溶液的烧杯用少量蒸馏水润洗
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗
⑤氯化钠晶体不纯.
| A.①②③④⑤ | B.只有①②④⑤ | C.只有①②③ | D.只有②③④⑤ |
用氯化钠固体配制50g质量分数为5%氯化钠溶液,下列仪器中需要用到的是
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
 |
 |
 |
 |
 |
 |
 |
A.②④⑥⑦ B.①④⑤⑥
C.①③⑤⑦ D.①③④⑥
20℃时,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,有关说法不正确的是( )
| 物 质 |
甲 |
乙 |
丙 |
| 未溶解固体的质量/g |
7 |
0 |
3 |
A.所得溶液可能都是饱和溶液
B.三溶液中溶质的质量分数乙>丙>甲
C.升高温度,三溶液中溶质的质量分数一定会改变
D.20℃时,甲溶液的溶质质量最小