氯化钠、硝酸钾、硒酸镉的溶解度曲线如下图所示。据图回答:
(1)若硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 。
(2)t℃时,溶解度最小的是 。
(3)t℃时,下图是配制硒酸镉饱和溶液的有关操作示意图:
①配置硒酸镉饱和溶液的正确顺序是 (填序号).
②将25g硒酸镉加入 g水中,完全溶解后,恰好得到硒酸镉饱和溶液。
③要进一步提高该溶液的溶质质量分数,可进行的操作是 。
④若用量筒取水时仰视读数,其它操作正确,则配得硒酸镉饱和溶液的质量分数 (填“偏大”、“偏小”或“正确”).
实验室要配制100 g溶质质量分数为3% 的氯化钠溶液。
(1)步骤:①计算:需要氯化钠的质量 g;②称量固体氯化钠;③量取一定体积的水;④ ;⑤装瓶;⑥贴标签。
(2)以下操作正确的是 (填序号)。
水和溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)在日常生活中常采用方法使硬水软化;洗衣服需要用水,但衣服上沾有油漆却很难用水清洗干净,可用汽油清洗,是因为汽油能油污;
(2)电解水的实验中,负极和正极产生的气体体积比大约是;
(3)配置溶质质量分数为3%的氯化钠溶液时,可用溶质质量分数为6%的氯化钠溶液和水配制,若量取溶质质量分数为6%的氯化钠溶液时仰视读数,其他操作均正确,则配制的溶液中溶质质量分数3%(填">"、"<"、"=")。
实验室配制50 g 16%的氯化钠溶液的操作如下图所示。①中玻璃棒的作用是 ;称量的食盐质量为 ;该实验的正确操作顺序为 (填序号)。
配制100 g 5%的氯化钠溶液,主要步骤是:计算、称量、量取、溶解、装瓶贴标签。
(1)溶解过程中用到的仪器有 。
(2)实际配制的溶液中溶质的质量分数小于5%,其原因可能有 。
| A.氯化钠固体不纯 | B.固体倒入烧杯时洒落 |
| C.配制时烧杯不干燥 | D.装瓶时有液体溅出 |
| 序号 物质 |
① |
② |
③ |
④ |
| 液体 |
|
|
|
|
| 固体 |
|
|
|
|
下图为甲、乙、丙三种不含结晶水的固体物质溶解度曲线,据图回答:
①图中 ⒁物质的溶解度曲线与气体物质溶解度曲线受温度影响变化相似。
②t1℃时,25g甲物质的饱和溶液中,含甲物质⒂克。
③t3℃时,取等质量甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量最小的是 ⒃ 物质。
④现有甲、乙、丙三种物质的浓溶液,可用海水晒盐原理进行结晶提纯的是 ⒄ 物质。
⑤下列叙述中错误的是 ⒅ 。
| A.t1℃时,甲、乙、丙三种物质溶液的溶质质量分数可能相等 |
| B.t2℃时,甲、乙物质溶解度相等,则两种溶液的溶质质量分数也相等 |
| C.t1℃时,甲、乙、丙三种物质的溶液分别升温(溶剂不蒸发),丙物质溶液浓度可能发生改变 |
| D.t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃时,析出晶体最多是甲物质 |
通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于__________变化(填“物理”或“化学”)。粗盐经过__________、过滤、__________[可得到初步提纯,再通过化学方法获得精盐。
以化学的视角来认识青奥会。
(1)图A中金可以压制成金币,说明金具有良好的 性。某纪念币是由合金铸造的,其熔点比成分金属熔点 (填“高”或“低”)。
(2)为减少传统燃油汽车的尾气污染,南京近期投入了一批液化天然气公交车和电动公交车。
①写出天然气燃烧的化学方程式 。电动公交车上的电池是将化学能转化成 能的装置。
②电动车一般使用铅酸蓄电池。某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸。若用50 g质量分数为98%的浓硫酸配制该稀硫酸时,需要加水 mL(水的密度为1g/mL);在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、装瓶并贴上标签;若用量筒量取浓硫酸时俯视读数,所配溶液中溶质的质量分数 20%(填“大于”、“小于”或“等于”)。
探究影响食盐在水中溶解速率的因素:
小英在做饭时,发现很多因素都能影响食盐在水中溶解的速率.
(1)从你能想到的可能影响食盐在水中溶解速率的因素中,写出其中两项,并预测此因素对食盐溶解速率的影响:
因素① ,
你的预测 ;
因素② ,
你的预测 .
(2)从你所列因素中选出一个,通过实验验证你的预测.你设计的实验方案是: .
如图是某试剂瓶标签上的内容.要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为_________g.稀释浓H2SO4时,要将_________慢慢沿___________慢慢注入___________中,并 .如果不慎浓硫酸沾到衣服上或手上,应立即用大量 冲洗,然后涂上 。量取浓硫酸时仰视读数,会导致结果 (偏大、偏小)。

溶液在生命活动中起着十分重要的作用。
(1)下列物质与水充分混合后,能形成溶液的是__________。
| A.花生油 | B.葡萄糖 | C.面粉 | D.冰 |
(2)医疗上常用0.9%的氯化钠溶液作为生理盐水,生理盐水中的溶质为__________。一袋100mL(密度约为1g/mL)的生理盐水,所含溶质的质量是__________。
下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上图表示的序号表示配制溶液的正确操作顺序_____________。
(2)图②中,有一种塑料仪器,其名称是_________。
(3)(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为_____。
(4)根据计算需要量取水的体积是________(水的密度为1g/mL)。量取读数时,下图视线角度正确的是_____。(选填字母标号)
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数________(填“大于”、“小于”或“等于”)10%。
(3分)下图表示某物质在水(a)和酒精(b)中的溶解度曲线。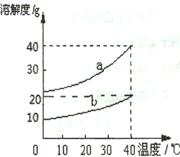
(1)40℃时,该物质在酒精中的溶解度为 。
(2)影响该物质在水和酒精中的溶解度的主要因素是 。
(3)40℃时,其饱和水溶液的溶质质量分数为: 40%(填“>”、“=”或“<”)。
在实验课上,老师要同学们配制15%的氯化钠溶液50 g。
(1)计算:配制15%的氯化钠溶液50 g,需氯化钠的质量为 g。
(2)甲同学按下图所示步骤依次操作。
其错误的操作步骤有 (填字母序号);B中仪器名称为 ;E中玻璃棒的作用是 。
(3)乙同学在将称量好的氯化钠倒入烧杯中时,不小心有一部分氯化钠固体撒出,则其所配溶液溶质质量分数与15%相比 (填“偏低”、“偏高”、或“相等”)。
(1)从微观角度看物质的变化是化学的思维方式之一。下面两幅示意图分别表示生成氯化钠的不同化学反应。请根据图示回答相关问题:
①图1是金属钠与氯气反应生成氯化钠的微观示意图。由图1可知,元素的化学性质与其微粒的 (填字母序号)有密切关系。
| A.最外层电子数 | B.内层电子数 | C.电子层数 | D.核电荷数 |
②图2描述了NaOH溶液与盐酸反应的微观实质是 。
(2)用质量分数为6%的氯化钠溶液(密度为1.04g/cm3),配制100g质量分数为3%的氯化钠溶液。配制过程为:
①计算(计算结果保留一位小数):需6%的氯化钠溶液 mL(计算的依据是 ),水 g。
②量取;
③ ;
④装瓶、贴标签。