北京市通州区初三化学统一练习(一模)化学试卷
生活中常遇到“碘盐”、“高钙牛奶”、“铁强化酱油”等商品,这里的“碘、钙、铁”是指
| A.元素 | B.原子 | C.分子 | D.单质 |
缉毒犬能根据气味发现毒品,这说明
| A.分子很小 | B.分子是可分的 |
| C.分子在不断运动 | D.分子之间有间隔 |
下列对水的认识正确的是
| A.长期饮用蒸馏水对身体有益 |
| B.在河水中加入明矾可除去所有杂质 |
| C.水体有自净能力,未经处理的生活污水可任意排放 |
| D.在淡水资源缺乏的海岛上,可考虑用蒸馏法从海水中提取淡水 |
钾可以促进植物生长、增强抗病虫害能力。下列物质中,能用作钾肥的是
| A.KCl | B.CO(NH2)2 | C.NH4Cl | D.Ca3(PO4)2 |
下列物质的用途中,主要利用其化学性质的是
| A.氦气填充气球 | B.石墨作电极 |
| C.水银填充温度计 | D.氧气用于制炸药 |
下列处理事故的方法不正确的是
| A.油锅着火用水浇 |
| B.电器着火应先切断电源,再用二氧化碳灭火器扑灭 |
| C.厨房煤气管道漏气,立即关闭阀门并开窗通风 |
| D.扑灭森林火灾的有效方法之一是将大火蔓延路线前的一片树木砍掉 |
日本福岛发生核泄漏事故,核电站泄漏出来的放射性物质中含有铯-137。已知铯-137的质子数为55,中子数为82,下列有关铯-137的说法正确的是
| A.原子的核外电子数为82 | B.相对原子质量为137g |
| C.核电荷数为55 | D.属于非金属元素 |
下列生活垃圾可与铝制易拉罐归为同一类加以回收的是
| A.废旧书报 | B.旧玻璃瓶 |
| C.废弃铁锅 | D.一次性塑料饭盒 |
下列实验现象描述正确的是
| A.铁丝在氧气中剧烈燃烧,发出白光 |
| B.打开浓硫酸的试剂瓶盖,瓶口会出现白雾 |
| C.在电解水实验中,电源的正负极产生气体的体积比为2∶1 |
| D.空气中氧气体积分数测定实验结束后,进入集气瓶中水的体积约为集气瓶中气体体积的1/5 |
甲烷和水反应也可以制水煤气,其反应的微观示意图如下所示:
下列对该反应的叙述正确的是
| A.反应前后分子个数不变 |
| B.生成物丙中各元素的质量比为1∶1 |
| C.生成的丙和丁的分子个数比为1∶1 |
| D.若有24g的甲参加反应,则生成丁的质量为9g |
通过下列实验操作和现象能得出相应结论的是
| |
实验操作 |
现象 |
结论 |
| A |
向收集满CO2的软塑料瓶中加入约1/3体积的NaOH溶液,旋紧瓶盖,振荡 |
塑料瓶变瘪 |
CO2能与NaOH反应 |
| B |
向某白色粉末中滴加适量稀盐酸 |
白色粉末消失,产生气泡 |
白色粉末是Na2CO3 |
| C |
向稀盐酸与NaOH溶液反应后的试管中滴加无色酚酞 |
溶液无明显现象 |
恰好完全反应 |
| D |
点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 |
烧杯内壁有无色液滴产生 |
该气体中含H元素 |
甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是
| A.甲物质的溶解度大于乙物质的溶解度 |
| B.甲的溶解度受温度影响较小 |
| C.t1℃时,甲、乙两物质各50g分别加入100g水中,充分溶解,得到的溶液质量都是140g |
| D.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 |
下列四个图像分别对应四个变化过程,其中正确的是
| A.服用胃舒平[主要成分Al(OH)3]治疗胃酸过多(胃液pH随时间变化图) |
| B.向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸溶液直至过量 |
| C.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应 |
| D.将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出 |
(1)奶制品、豆类和虾皮等含有丰富的钙,青少年缺钙会导致 (填字母序号)。
A.佝偻病 B.贫血 C.甲状腺肿大
(2)我们每天吃的米、面中富含大量的 (填字母序号),它是人体能量的主要来源。
A.糖 B.维生素 C.油脂
(1)生活中可用小苏打(NaHCO3)治疗胃酸过多,其反应方程式是 。
(2)某同学取少量厨房清洁剂,滴入石蕊溶液后呈蓝色,说明此厨房清洁剂显 性。
(3)外卖冰激凌中放入干冰可以使其不易融化,干冰的化学式是 。
(1)食品包装内充N2以防腐,因为N2的化学性质 。
(2)“双吸剂”主要成分是还原铁粉,可延长食品保质期,因为铁粉可与H2O和 反应。
(3)生石灰可用做干燥剂,用化学方程式表示其原理 。
(4)过氧化氢分解过程中产生的氧可将牛乳中的溶解氧经酶促反应除去,从而保护鲜奶中的Vc和其他易被氧化的物质,延长鲜牛奶的保质期。过氧化氢分解的化学方程式是 。
(1)二氧化碳主要来源于化石燃料的燃烧,化石燃料包括天然气、煤和 ,其中天然气完全燃烧的化学方程式为 ;浴室内不能安装直排式燃气热水器以防燃气不充分燃烧产生 。
(2)烧碱在工业生产和生活中有着广泛的用途,很早以前人们就知道用纯碱溶液和石灰乳[Ca(OH)2和H2O]混合来制备烧碱。该反应的化学方程式为 。
(1)地壳中含量最多的金属元素是 。
(2)生活中的钢铁制品通常是铁的合金,合金属于 (填“混合物”或“纯净物”)。
(3)一般的导线由铜丝组成,说明铜有其良好的 性(填一条)。
(4)早在西汉时期,人们主要采用“湿法冶金”。如将铁浸入硫酸铜溶液中,该反应的化学方程式为 ,基本反应类型为 。
(1)自来水厂净水过程中常用活性炭,活性炭的主要作用是 。
(2)生活中可以用 鉴别自来水是不是硬水。
阅读下列科普短文:
都市中的光化学烟雾在温暖、干燥而且阳光充足的日子特别严重。它的原级污染物,主要是一氧化氮(NO)。一氧化氮乃是空气中的氮气和氧气,在汽车引擎的高温下,相互反应而生成。事实上,这个一氧化氮的生成过程,与闪电时产生一氧化氮的过程相同。其他光化学烟雾的原级污染物,包括汽油挥发所产生的碳氢化合物和一氧化碳(CO)。
一氧化氮是一种无色的气体,但是当它从汽车废气排入空气后,与空气中的氧气反应,产生红棕色的二氧化氮。二氧化氮(NO2)可以与空气中的水分子起作用,而生成硝酸(HNO3)和亚硝酸(HNO2)。这个反应同时也会帮助空气中的水汽凝聚。但是由于硝酸及亚硝酸的酸性极强,如果吸入含有这种液体微滴的空气,将对人体造成相当程度的伤害。
依据文章内容,回答下列问题:
(1)NO的物理性质 。
(2)NO和NO2的化学性质不同的原因 。
(3)用化学方程式表示产生NO的过程 。
(4)NO2和H2O反应的化学方程式是 。
(5)你认为应该如何防止光化学污染 。(写一条即可)
过氧化钙(CaO2)是一种多功能无机化合物,通常由Ca(OH)2为原料制得,制备流程如下: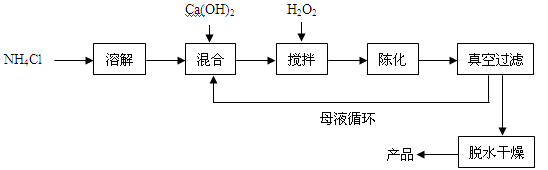
(1)原料中NH4Cl中氮元素的化合价是 ,NH4Cl中氮元素的质量分数为 %(精确到 0.1%)。
(2)请将搅拌过程中发生反应的化学方程式补充完整:
CaCl2 + H2O2 + 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl。制备过程中除水外可循环使用的物质是 (填化学式)。
一种工业废水中含有大量的硫酸亚铁、少量硫酸铜和污泥(污泥不溶于水,且不参与化学反应)。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下:
【查阅资料】FeSO4·7H2O受热易分解。
回答下列问题:
(1)加入过量试剂a的目的是 。
(2)操作③中产生气体的化学方程式是 。
(3)下列说法正确的是 。
| A.溶液1中的溶质质量一定大于溶液2中的溶质质量 |
| B.溶液3中的质量分数大于或等于溶液2 |
| C.操作④中可以用蒸发溶剂结晶的方法 |
| D.操作③中所加物质一定要适量 |
下列用字母表示的物质由H、C、O、Na、Cl、Ca、Fe中的一种或几种元素组成,它们是初中化学常见的物质。
(1)A溶于水放出大量的热,在空气中极易潮解。A的俗称为 。
(2)B为红色的固体,B、C固体分别与D的溶液反应后分别生成E、F,E、F含有两种相同元素且两种物质的溶液颜色不同。则E、F含有的相同元素元素是 ;B与D溶液反应的化学方程式为 ;B与某气体反应生成C,则该反应的化学方程式为 。
(3)取G的固体53g与足量的D溶液反应产生22g气体,则G与D溶液反应的化学方程式为 。
根据下图所示制取气体的装置,回答下列问题(装置选择用序号填写):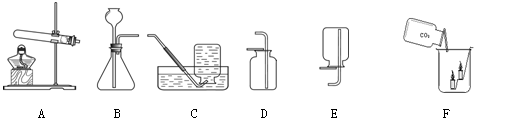
(1)用A做发生装置制取氧气时,反应的化学方程式为 。
(2)用大理石和稀盐酸制取二氧化碳时,反应的化学方程式为 ;如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是: (写两条)。
实验室要配制100 g溶质质量分数为3% 的氯化钠溶液。
(1)步骤:①计算:需要氯化钠的质量 g;②称量固体氯化钠;③量取一定体积的水;④ ;⑤装瓶;⑥贴标签。
(2)以下操作正确的是 (填序号)。
实验小组同学要测定某块农田土壤的酸碱性。
(1)将土壤样品与蒸馏水按1∶5的质量比在烧杯中混合,充分搅拌后静置,要将固体与液体分离须进行的操作是 。
(2)用玻璃棒蘸取少量待测液滴在pH试纸上,与比色卡对照后得出pH<7,则该片土壤显 性,为调节土壤的酸碱性,可以向土壤中撒适量的 。
某实验小组根据下图所示装置(图中固定装置省略)探究燃烧的条件和酸、碱、盐的性质,其中装置甲的试管中盛有固体粉末B,分液漏斗中盛有足量溶液A,装置乙中盛有足量液体。请回答问题:
(1)关闭K1,打开K2,若装置乙中水下有少量白磷(此时水温35℃),实验时将足量A(H2O2溶液)滴加到B(MnO2)中后,关闭分液漏斗活塞,则乙中有气泡冒出,白磷不燃烧,说明燃烧还需要 ;若迅速关闭K2,待反应一段时间后打开K1,可能出现的现象是 ,且白磷燃烧。
(2)关闭K1,打开K2,装置乙中有石灰水。实验时将A(盐酸)滴加到B(白色固体)中后,关闭分液漏斗活塞,看到乙的溶液中有气泡冒出,变浑浊,那么乙中反应的化学方程式是 ;当甲中不再产生气泡后,在不改变装置的情况下,进行以下操作 ,能使乙中液体流入甲中。
某化学兴趣小组的同学对能制氧气的呼吸面具进行研究。
[查阅资料]
(1)呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2)。过氧化钠分别能和二氧化碳、水反应,都生成氧气,反应的化学方程式为:
①2Na2O2+ 2H2O ═ 4NaOH + O2↑
②2Na2O2+2CO2 ═ 2Na2CO3+ O2
(2)氯化钙溶液呈中性;碳酸钠溶液呈碱性;氯化钙溶液与碳酸钠溶液混合后发生如下反应:
Na2CO3+ CaCl2 ═ CaCO3↓ + 2NaCl。
同学们对用过一段时间后的面具中的固体成分产生兴趣。
[猜想与假设]
固体可能为:①Na2CO3;②NaOH和Na2CO3;③Na2O2和Na2CO3;④ 。
为了确定用过一段时间后呼吸面具中的成分,该小组的同学在老师的指导下进行了以下的探究。
[进行实验]
实验Ⅰ:取少量固体放入试管中,加足量水,看到 ,证明固体中有Na2O2。
实验Ⅱ:取少量固体放入试管中,滴加足量的稀盐酸,产生大量气泡,则证明固体中含有Na2CO3。
实验Ⅲ:取少量固体放入试管中,加足量水,再滴加足量的氯化钙溶液后,过滤。向滤液中加入酚酞试液,若溶液变成 ,则证明固体中含有NaOH。
[反思与评价]
通过上述实验,有些同学认为其中有些不妥的结论。
(1)有些同学认为通过实验Ⅱ并不能确定固体中含有Na2CO3。如何改进此实验? 。
(2)还有些同学认为通过实验Ⅲ也不能证明固体中一定含有NaOH。其原因是: 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号