(3分)下图表示某物质在水(a)和酒精(b)中的溶解度曲线。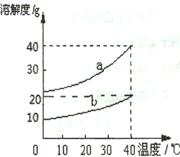
(1)40℃时,该物质在酒精中的溶解度为 。
(2)影响该物质在水和酒精中的溶解度的主要因素是 。
(3)40℃时,其饱和水溶液的溶质质量分数为: 40%(填“>”、“=”或“<”)。
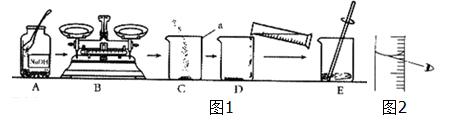
以下是氯化钠溶液的配制和粗盐中难溶性杂质的去除(需要计算粗盐的产率)实验的部分操作。

(1)仪器a的名称是 。
(2)完成粗盐提纯的实验上图中正确的操作顺序为 (填字母序号)。
(3)配制6%的氯化钠溶液和粗盐中难溶性杂质的去除都要用到的实验操作是 (填序号)。
(4)A中玻璃棒搅拌的作用是使氯化钠 。D操作中,当观察到蒸发皿中出现 时,停止加热。
(5)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
| A.增加适量氯化钠固体 | B.减少适量氯化钠固体 |
| C.调节游码 | D.添加砝码 |
(6)用提纯得到的精盐配制了50 g 6%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯 ②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
实验室要配制100 g溶质质量分数为3% 的氯化钠溶液。
(1)步骤:①计算:需要氯化钠的质量 g;②称量固体氯化钠;③量取一定体积的水;④ ;⑤装瓶;⑥贴标签。
(2)以下操作正确的是 (填序号)。
(I)下图是小红同学设计的一组“吹气球”的实验。请回答:
(1)甲装置中,向a中加水会看到气球胀大,一段时间内观察到 ,说明该装置气密性良好。
(2)乙装置中,若锥形瓶中装有NaOH固体,分液漏斗中加入少量水,则气球胀大的主要原因是 。
(3)丙装置中,若锥形瓶中盛满CO2,欲使气球胀大,分液漏斗中的液体可以是 。
(II)实验室配制50 g 16%的氯化钠溶液的操作如下图所示。
①中玻璃棒的作用是 ;称量的食盐质量为 ;该实验的正确操作顺序为 (填序号)。
(III)某实验小组利用下图所示装置进行研究CO2性质和燃烧条件的实验。
(1)研究CO2与水反应:进行此实验时,将C装置a、b两端分别与B、D装置连接,A中液体为紫色石蕊溶液,B中固体为碳酸钠,C中液体为浓硫酸,D中放一朵干燥的紫色石蕊小花。将分液漏斗中的稀硫酸滴入B中。A中发生反应的化学方程式为 ;观察到 ,说明使紫色石蕊变色的是碳酸、不是CO2。
(2)研究燃烧的条件:进行此实验时,将C装置b、a两端分别与B、 D装置连接,A和C的液体底部靠近导管口分别固定一小块白磷,B中固体为二氧化锰。将分液漏斗中的液体滴入B中。B中发生反应的化学方程式为 ;A液体为冷水,C中液体为 ;观察到 ,说明可燃物燃烧需要与氧气接触、温度达到着火点。
(1)在H、C、O、Ca四种元素中,选择适当的元素组成符合下列要求的物质。(填写化学式)
①沼气的主要成分 ,
②最常见的溶剂
③可被人体直接吸收的糖 ,
④常用的食品干燥剂
(2)水和空气是人类赖以生存的自然资源。
①下列有关水和空气的叙述中正确的是
A.人们饮用的纯净水中不含任何化学物质
B.水是生命之源,保护水资源包括防止水体污染和节约用水两方面
C.目前计入空气质量日报的主要污染物中已包括了二氧化碳
D.充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生
②铁制品在空气中易锈蚀,其实质是铁与空气中的 等接触后发生了化学反应。
③溶解了较多的可溶性钙和镁的化合物的水属于硬水,生活中一般可用 的方法来降低水的硬度。
④实验室欲将50g质量分数为6%的氯化钠溶液稀释为3%的稀溶液,需加水的体积为 _mL。
如图为甲、乙两种固体物质在水中的溶解度曲线,据此回答下列问题:

(1)在40℃时甲、乙两种固体物质的溶解度 (填“相同”或“不同”).
(2)两种物质中 物质的溶解度随温度的升高而降低.(填“甲”或“乙”)
(3)若要从甲的60℃的饱和溶液中得到甲(固态),应该采用 的方法.(填序号)
A.升高温度到70℃
B.降低温度
C.加入一定量的水.
在实验室里可用以下两种方法配制质量分数为10%的
溶液

(1)方法一中配制100g 10%的
溶液,需要
固体g。
(2)方法二中用量筒量取25%的
溶液时仰视读数,其他操作均正确,所配溶液中溶质的质量分数10%(选填"大于"、"小于"或"等于");
(3)方法一中的"溶解"和方法二中的"混匀",都要用到的仪器是。
在实验课上,老师要同学们配制15%的氯化钠溶液50 g。
(1)计算:配制15%的氯化钠溶液50 g,需氯化钠的质量为 g。
(2)甲同学按下图所示步骤依次操作。
其错误的操作步骤有 (填字母序号);B中仪器名称为 ;E中玻璃棒的作用是 。
(3)乙同学在将称量好的氯化钠倒入烧杯中时,不小心有一部分氯化钠固体撒出,则其所配溶液溶质质量分数与15%相比 (填“偏低”、“偏高”、或“相等”)。
实验室配制50 g 16%的氯化钠溶液的操作如下图所示。①中玻璃棒的作用是 ;称量的食盐质量为 ;该实验的正确操作顺序为 (填序号)。
12gA物质溶于228g水中,所得溶液平均分为三等份。
(1)每一份溶液的质量分数为_______________;
(2)将第一份溶液中加入10g水,所得溶液中溶质的质量分数为___________;(计算结果保
留小数点后一位数字)
(3)在第二份溶液中再溶解10gA,所得溶液的溶质质量分数为____________;(计算结果保留小数点后一位数字)
(4)再将第三份溶液稀释为原溶液的溶质质量分数的一半,应加水的体积为_______________。
探究学习小组在制作"叶脉书签"时,需要将树叶放在质量分数为
的氢氧化钠溶液中煮沸,如图1所示为该小组配制
的氢氧化钠溶液的操作过程:
(1)图1中仪器
的名称是,写出该仪器的另一种用途;
(2)操作
中,必须将氢氧化钠固体放在里,并置于托盘天平盘(填"左"或"右")进行称量;
(3)操作
中,用量筒量取所需体积的蒸馏水时还用到(填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数(填写"偏大"、"偏小"或"无影响").
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上.
(5)制作"叶脉书签"结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是(填写字母标号)
| A. |
玻璃棒 |
B. |
pH试纸 |
C. |
酚酞试液 |
D. |
白瓷板(或玻璃片) |
水在生活、生产和化学实验中起着十分重要的作用.
(1)水的净化.向浑浊的天然水中加入明矾,静置一段时间后,取上层液体过滤,得到略带颜色的液体。实验中加入明矾的作用是,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、(填仪器名称),其中玻璃棒的作用是。
(2)水的组成.用如图1实验装置可以证明水的组成,检验
处气体的方法是。
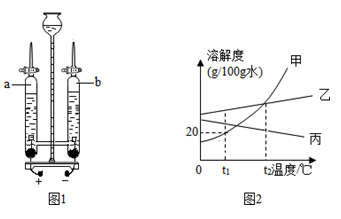
(3)水的用途.水是常用的溶剂.如图2为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
①
,若将
甲物质放入
水中充分溶解得到g溶液。
②若固体乙中混有少量固体甲,提纯乙的方法是:溶解、过滤。
③将
时丙的饱和溶液降温到
时,丙溶液为(填"饱和"或"不饱和")溶液,溶质质量分数(填"变大"、"变小"或"不变")。
配制50g质量分数为5%的氯化钠溶液,下图是某同学配制溶液的操作过程: (1)写出标号①~④各仪器的名称:

①______________ ②______________ ③______________ ④______________
(2)B操作中应称氯化钠的质量是______________g,称量时若指针偏右,应进行的操作是_____________________。
(3)D操作中仪器⑨的规格应为______________(填“10mL”、“50ml”或“100mL”)读数时应使视线与___________________保持水平。
(4)E操作的作用是____________________。
(5)下列错误操作可能导致溶质质量分数偏低的是______________。(填序号)
①B操作中砝码和氯化钠放错托盘 ②D操作中仰视凹液面的最低处读数
⑨D操作时有少量水溅出 ④F操作中溶液洒落
如图是配制溶质质量分数为10%的
溶液的实验操作示意图:
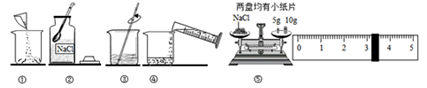
(1)用图中序号表示配制溶液的正确操作顺序;
(2)图②中用来取用
的仪器是;
(3)称量
时,天平平衡后的状态如图⑤所示,游码标尺示位置见图,则称取的
质量为g;
(4)
称量完毕放回砝码时,发现10g的砝码有缺损,若其他操作步骤正确,则所配制溶液的质量分数(填"大于"、"小于"或"等于")10%。
配制50g质量分数为10%的氢氧化钠溶液,下列失误会导致所配溶液溶质质量分数偏大的是()
| A. | 装瓶时,有溶液洒出 |
| B. | 将量筒中的水倒入烧杯时有水溅出 |
| C. | 溶解时未用玻璃棒搅拌 |
| D. |