右图是A、B两种固体物质的溶解度曲线。下列说法中错误的是
A.t1℃时A、B的溶解度相等
B.t2℃时,A的饱和溶液中溶质的质量分数为a÷100×100﹪
C.A、B的溶解度都随温度升高而增大
D.将t2℃时B的饱和溶液降温到t1℃时,溶液变稀了
图表资料可以为我们提供很多信息,下列从图表中获取的信息及应用不正确的是
| A.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀 |
| B.根据金属的熔点数据表,判断金属的导电性强弱 |
| C.根据溶解度曲线图,选择从溶液中获得晶体的方法 |
| D.根据元素周期表,查找元素的原子序数、元素符号、相对原子质量 |
根据右图所示的溶解度曲线,回答下列问题。

(1)10
时,将
、
各30
分别加入到100
水中,充分搅拌后,固体全部溶解的是;
(2)将
的饱和溶液转化为不饱和溶液,通常采用的方法有:加水和。
图是甲、乙两种物质的溶解度曲线,图所示两个烧杯中各盛有
时上述两种物质的饱和溶液.请你通过分析,回答下列问题:

( 1 )
时,甲物质与乙物质的溶解度(填"相等"或"不相等")
( 2 )
时,
水中最多可溶解甲物质
,
( 3 )当温度由
升高至
时(不考虑水分蒸发),
烧杯中固体质量增加,则
烧杯溶液中的溶质是(填"甲"或"乙")
甲、乙两种不含结晶水的固体物质的溶解度曲线如图l所示。下列说法正确的是()
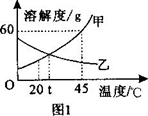
| A. | 20℃时甲物质的溶解度为60克 |
| B. | 升高温度可使不饱和的甲溶液变为饱和 |
| C. | 将45℃时甲、乙的饱和溶液分别降温到 时,两溶液均析出晶体 |
| D. | 时,甲、乙两物质的溶解度相等 |
下列说法正确的是
| A. | 质子数相同的微粒一定是同种元素 | B. | 酸性溶液一定是酸的溶液 |
| C. | 某温度下的浓溶液一定是饱和溶液 | D. | 生铁比纯铁硬 |
通过一年的化学学习,你认为下列描述正确的是()
| A. | 镁条在空气中燃烧后质量增重不符合质量守恒定律 |
| B. | 要注意合理摄入人体必需元素,不足或过量均不利健康 |
| C. |
从酸、碱、盐溶解性表中可以
 查出物质的溶解度大小 查出物质的溶解度大小
|
| D. |
化学是研究
 物质的组成、结构、性质和运动规律的科学 物质的组成、结构、性质和运动规律的科学
|
(4分)如图是甲、乙两种固体物质的溶解度曲线。
(1)t1℃时,甲的溶解度______乙的溶解度(选填“大于”、“等于”或“小于”)。
(2)要使接近饱和的甲溶液变为饱和溶液,可采取的方法是_____________(只填一种)。
(3)甲、乙各Wg分别加入到两只盛有100 g水的烧杯中,充分搅拌,在t3 ℃时所得乙溶液为_______溶液(选填“饱和”或“不饱和”);若将温度都降低到t2 ℃,甲溶液中溶质的质量分数________乙溶液中溶质的质量分数(选填“大于”、“等于”或“小于”)。
右图是
、
、
三种物质的溶解度曲线图。请回答:

(1)
时,
物质的溶解度是。
(2)
、
两种物质的溶解度相等的温度是
。
(3)
时,
、
、
三种物质溶解度由大到小的顺序是。
以下是 的部分溶解度数据,下列说法中正确的是()
| 温度/℃ |
0 |
20 |
40 |
60 |
| 溶解度/g |
27.6 |
34.0 |
40.0 |
45.5 |
| A. |
饱和溶液中不能再溶解其他物质 |
| B. |
20℃时,100g饱和 溶液中含 34.0g |
| C. |
20℃时, 溶液中溶质的质量分数一定小于40℃时溶液中溶质的质量分数 |
| D. |
60℃时将溶质质量分数为30%的 溶液降温至40℃时,有晶体析出 |
甲、乙两种固体物质(不含结晶水)的溶解度曲线如下图所示。下列说法正确的是()
| A. | 甲物质的溶解度大于乙物质的溶解度 |
| B. | ℃时,甲、乙两物质的溶解度相等,均为40g |
| C. | ℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 |
| D. | 甲的溶解度受温度影响较小 |

溶液在生活和生产中应用广泛。
(1)下列物质中,属于溶液的是 。
| A.糖水 | B.牛奶 | C.碘酒 | D.汽油 |
(2)配制2000g质量分数为0.08%的生理食盐水,需要称量 g食盐。
(3)根据图1和图2回答问题: 
20 ℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象。20 ℃时, (填“甲”或“乙”)的溶液一定是饱和溶液。图2中表示甲物质的溶解度曲线的是 (填“a”或“b”);若20 ℃时a的饱和溶液降温到10 ℃,其溶质质量分数 (填“变大”、“变小”或“不变”)。
甲、乙两种物质的溶解度曲线如图所示,下列叙述中,正确的是
| A.t1OC时,甲、乙各30g加入到70g水中,均能恰好完全溶解 |
| B.t1OC时,甲和乙的饱和溶液中溶质的质量分数相等 |
| C.t2OC时,在100g水中加入60g甲,所得溶液中溶质的质量分数为37.5% |
| D.t2OC时,分别在100g水中溶解20g甲、乙,同时降温,乙先达到饱和 |
溶液的组成和配制是初中化学中的重要知识,在生产生活中有广泛的应用。
(1)右图为氯化钠、硝酸钾在水中的溶解度曲线。
氯化钠溶液中的溶剂是 。20℃时,硝酸钾的溶解度约为 g。30℃时,硝酸钾的溶解度 氯化钠的溶解度。(填 “大于”、“小于”或“等于”)
(2)某学校化学兴趣小组用不纯的氯化钠固体(含有的杂质CaO)来配制一定溶质质量分数的NaCl溶液,实验的流程图如下: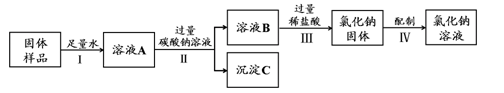
①溶液A中的溶质为 。
②操作II的名称是 。
③过量稀盐酸加入到溶液B中所发生反应的化学方程式为 。
右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 ① 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,能形成
80g溶液吗? ② (填写“能”或“不能”)。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是
③ (填写物质序号)。
(4)将t2℃时a、b、c三种物质等质量的饱和溶液降温到t1℃时,析出晶体最多的是 ④ (填写物质序号)。