如图是硫在氧气中燃烧的实验改装装置:
(1)写出分解过氧化氢制取氧气的化学方程式: 。
(2)硫在氧气中燃烧的现象是: 。
(3)本实验中电烙铁的作用是: 。
(4)配制50g溶质质量分数为5%的氢氧化钠溶液,需要氢氧化钠的质量 。
(5)本实验具有的优点是: 。(写一点即可)

化学是一门以实验为基础的学科
[实验一]常见气体的制取

(1)仪器a的名称 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),反应的化学方程式为 。
(3)实验室用A装置制取氧气,从燃烧条件分析,加热过程中试管内的棉花没有燃烧的原因是 。
[实验二]对比归纳是学习化学的重要方法

(4)实验A:观察到图2②中反应更剧烈,可知影响硫燃烧剧烈程度的因素是 。
(5)实验B:观察到图3 ④中固体消失,③中固体几乎不溶,可知影响物质溶解性的因素是 。
化学与生产、生活息息相关。
(1)水稻生长初期需要施氮肥,下列属于氮肥的是 。
A.K 2CO 3 B.(NH 4) 2SO 4 C.Ca 3(PO 4) 2 D.CO(NH 2) 2
(2)农业上常用溶质质量分数为16%的氯化钠溶液选种,现要配制100Kg这种溶液,需要 Kg氯化钠,配制该溶液的主要步骤有:①计算 ②称量 ③量取 ④ 。
(3)自行车是"绿色出行"的交通工具,为防止其链条生锈常采用的方法是 ;自行车支架使用的铝合金是 材料(填"金属"或"合成"),铝离子结构示意图如图 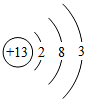 ,铝在化学反应中易 (填"得"或"失")电子,她的离子符号为 。
,铝在化学反应中易 (填"得"或"失")电子,她的离子符号为 。
泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注。根据要求回答问题:
Ⅰ.腌制泡菜时,蔬菜中的NaNO3转化为NaNO2.食用泡菜时,NaNO2与胃酸反应生成HNO2.HNO2不稳定,转化为某氮氧化物(常温下为红棕色气体)进入血液而中毒。
(1)NaNO2与胃酸(主要成分为盐酸)发生复分解反应,该反应的化学方程式为 。
(2)图1为泡菜生产和食用时涉及的四种含氮物质的类别及氮元素化合价关系图。其中,L的化学式为 。
(3)为检验某无色溶液是NaNO2还是NaCl,完成实验方案。
选取的试剂 |
实验现象 |
实验结论 |
|
|
该溶液为NaNO2溶液 |
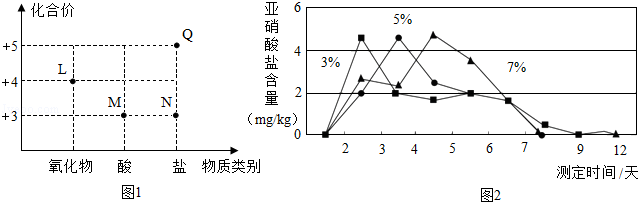
Ⅱ.室温下,用3%、5%和7%的食盐水浸泡蔬菜,浸泡不同时间获得的泡菜中亚硝酸盐的含量如图2所示。若往食盐水中添加少量维生素C,泡菜中亚硝酸盐含量明显降低。
(4)配制3%的NaCl溶液2000.0g,需用托盘天平称取 g的NaCl。
(5)食盐水的溶质质量分数越大,泡菜中亚硝酸盐含量最大值出现得 (填“越早”、“越迟”或“无影响”)。
Ⅲ.实际上,只要合理制作、食用泡菜,将有效避免(或降低)对人体的危害。
(6)列举一条避免(或降低)食用泡菜对人体危害的措施。
答: 。
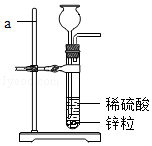
小明用锌粒和稀硫酸制取氢气,选用右图部分装置开展实验.根据要求回答问题:
(1)写出标号仪器的名称:
a ;b .
(2)实验过程中,制取、收集氢气的装置是 和 .
(3)制取氢气的化学方程式是 .
(4)实验时产生氢气很慢.小明根据老师建议,往制H2装置中滴入蓝色硫酸铜溶液,果然快速放出氢气.硫酸铜是否作催化剂?探究如下:往小烧杯中加入约20mL稀硫酸和约1mL硫酸铜溶液,再加入黄豆粒大的锌粒.反应停止时,溶液褪至无色、有红色物质生成.
①产生红色物质的原因 (填化学方程式);
②由上述实验可知,硫酸铜不是催化剂.理由是 .

豆腐是客家美食之一.豆腐制作过程如下:
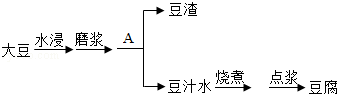
根据要求回答问题:
(1)豆浆 (填"是"或者"不是")溶液.
(2)"点浆"是使用MgCl 2、CaSO 4等凝固剂使豆浆凝固的过程.这些凝固剂的水溶液能导电,说明它们在水中溶解时能生成 .
(3)操作A为 .在实验室进行此操作,用到的玻璃仪器有烧杯、玻璃棒和 .
(4)食用豆腐有益于补充人体所需的蛋白质、预防骨质疏松症等.
①蛋白质对生命活动的重要意义是 ;
②豆腐能够预防骨质疏松症,说明豆腐含较丰富的 (填元素名称).
(5)豆腐中某成分会促进人体内碘的排泄.因此,食用豆腐时,可和 (填一种食物)搭配,解决食用豆腐可能引发的碘流失.
根据下列实验要求回答问题。

(1)写出图中仪器①、②的名称:① ,② 。
(2)实验室制取二氧化碳的化学方程式为 ,制取装置为 (填标号,下同)和 组合。检验二氧化碳的原理为 (用化学方程式表示)。
(3)实验室用高锰酸钾制取氧气的化学方程式为 ,可选用的发生装置为 (填标号)。
(4)若用水将图2所示的氧气从瓶内排出,水须从 (填"a"或"b")端导管口通入。
(5)实验室用碘化氢溶液测定过氧化氢溶液中溶质的质量分数,反应原理:H 2O 2+HI═2H 2O+I 2↓.取25.0g过氧化氢溶液,加入足量的碘化氢溶液,充分反应后生成12.7g碘。根据化学方程式计算该过氧化氢溶液中溶质的质量分数。
实验室用如图装置制取CO2。
(1)反应的化学方程式为 。
(2)用向上排空气法收集CO2的原因是 。

请从A或B两题中任选一个作答,若两题均作答,按35﹣A计分.
| A用浓硫酸配制100g 9.8%的稀硫酸 |
B粗盐中难溶性杂质的去除 |
| (1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有 (填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是 . |
(1)过滤需要用到的仪器有 (填序号). (2)蒸发过程中,需不断进行搅拌,其原因是 . |
| 可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 |
|
| |
|
Ba(NO 3) 2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO 3、BaSO 3、Fe 2O 3)可制取Ba(NO 3) 2,其部分流程如图:
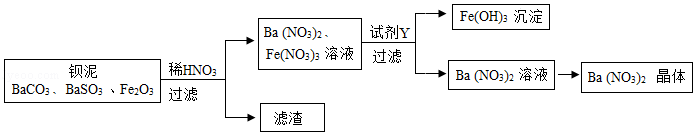
(1)Ba(NO 3) 2中钡元素的化合价为 ;流程中所涉及的氧化物是 (填1种即可)。
(2)BaCO 3与稀HNO 3反应的反应类型是 ;写出Fe 2O 3与稀HNO 3反应的化学方程式: 。
(3)试剂Y为 (填序号)。
①BaCl 2溶液 ②Ba(OH) 2溶液 ③NaOH溶液
(4)从Ba(NO 3) 2溶液中析出Ba(NO 3) 2晶体的方法是 。
如图是实验室中常见装置,回答下列问题。

(1)仪器a的名称是 。
(2)用装置A进行实验时,首先应 (填序号)。
①加药品
②加热
③检查装置气密性
(3)用A装置制取气体的不足之处是 。
(4)若要收集干燥的CO 2,可将含有水蒸气的CO 2从装置B的 (填"m"或"n")端导入,试剂X是 ;再用装置 (填"C"或"D"或"E")收集。
(5)向集满CO 2的集气瓶中加入澄清石灰水,反应的化学方程式为 。
如图是实验室中常见装置,回答下列问题。
查阅资料:常温下,CO 2难溶于饱和NaHCO 3溶液。
(1)仪器X的名称是 。
(2)实验室制取CO 2应选用的发生装置是 (填字母序号),反应的化学方程式是 ,该反应属于 (填反应类型)。
(3)常温下,下列收集CO 2的方法中不可行的是 (填字母序号)。
a.向上排空气法
b.向下排空气法
c.排饱和 NaHCO 3溶液法
(4)某同学进行图D所示的操作时,观察到高的蜡烛先熄灭,其原因可能是 。
五氧化二钒(V 2O 5)是一种工业催化剂,如图是制取V 2O 5的工艺流程。
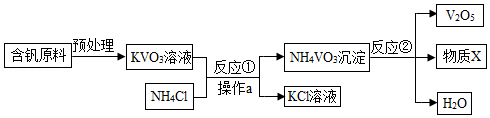
(1)写出反应①的化学方程式 。
(2)操作a的名称是 ,实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和 。
(3)反应②的反应类型是 ,物质X中一定含有的元素是 。
(4)写出副产物KCl的一种用途 。
实验室常用如图所示发生装置制备氢气。
(1)写出试管中反应的化学方程式 。
(2)仪器a的名称是 ,实验室可用 方法收集氢气。
(3)氢气作为新能源的优点是 (写出1点即可,下同),目前氢能源的大量使用仍存在一定困难,你认为针对氢能源的研究方向是 。
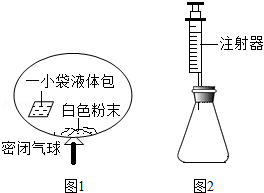
某研究小组对自动充气气球(示意图如图1)进行下列探究.
【查阅资料】该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用 (填试剂名称).
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈 性.
探究二:白色粉末成分的探究
【猜想与假设】甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
【设计并进行实验】
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想 (填"正确"或"不正确").
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
| 实验编号 |
锥形瓶内物质 |
最终得到CO 2体积/mL |
|
| 名称 |
质量/g |
||
| ① |
碳酸氢钠 |
0.10 |
V 1 |
| ② |
碳酸钠 |
0.10 |
V 2 |
| ③ |
白色粉末 |
a |
V 1 |
实验①的化学方程式为 ;表中a= ;V 1 V 2(填">"、"<"或"=").
【分析并得出结论】
(5)如何从上表中获取证据并得出结论? .