根据图所示的实验回答问题。
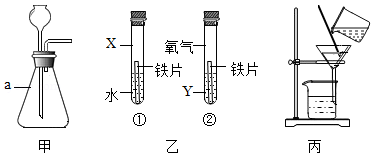
(1)甲装置中仪器a的名称是 ;该装置作为气体发生装置对反应物状态和反应条件的要求是 。
(2)乙是探究影响铁锈蚀快慢因素的实验,为探究氯化钠是否可以加快铁的锈蚀,试管①中的物质X和试管②中的物质Y分别是 。
(3)丙是粗盐提纯实验中的过滤操作。过滤时,最好先将上层液体倒入过滤器,然后再倒入混有沉淀的液体,以免 ,使过滤速度过慢。在粗盐提纯实验中,若颠倒液体时液面高于滤纸边缘(其他操作均正确)。则得到的精盐质量会 (选镇“偏大”“不变”或“偏小”)。
根据如图所示的实验回答问题

(1)甲实验中仪器a的名称是 ,进行粗盐提纯实验时过滤的目的是
(2)乙实验验证人体呼出气体中二氧化碳含量比空气中多时,除了要检验两种气体样品的体积相同外,还要控制 相同,实验现象是
(3)丙实验用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸则测得结果与实际值相比 (选择“偏大”、“偏小”或“相等”)
三沙市是我国位置最南、总面积最大(含海域)、陆地面积最小的地级市。
(1)永兴岛上的饮用水主要利用海水淡化膜对海水进行二级脱盐后获得。分离原理如图1所示,该原理与化学实验中常见的 操作相似;
(2)三沙海域的海水盐度高,从海水中获取食盐的方法是 ;
(3)海水提取粗盐后的母液还可以用来提取金属镁,其流程如图2:
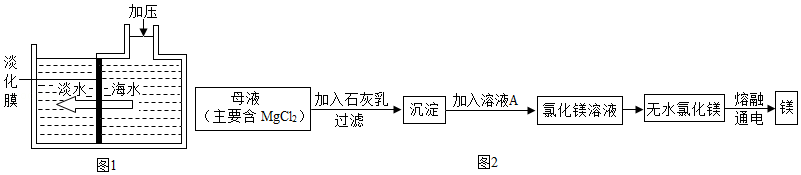
该流程中,溶液A为 ,其中没有发生的基本反应类型为 。
化学与生活密切相关,化学就在我们身边.
(1)下列食物中富含糖类的是 (填序号).
(2)某兴趣小组对清水江的水质状况进行调查研究.取回水样,在实验室静置后过滤,过滤需要用到的玻璃仪器有烧杯、漏斗和 .
(3)若要测定清水江江水的酸碱度,最适宜的是 (填序号)
A.紫色石蕊溶液 B.pH试纸 C.无色酚酞溶液
(4)当森林或草场发生火灾时,救火的措施之一是铲除火场周围一定宽度的树木和杂草,形成一道“防火墙”,其原理是 .
(5)烧碱露置在空气中不但会吸收空气中的水蒸气而潮解,还会发生变质,请你用化学方程式解释烧碱变质的原因 .
水是人类的宝贵自然资源,与人类的生产、生活密切相关。
(1)饮用酸、碱性过强或硬度过大的水都不利于人体健康,可用 来测定水的酸碱度。
(2)检验水是硬水还是软水,可用的物质是 ,日常生活中使硬水软化的方法是 。
(3)实验室用“电解水”或“氢气在氧气中燃烧”的实验探究水的组成元素,理论依据是 。
填写实验报告.
实验内容 |
实验现象 |
分析、结论及解释 |
(1)测定碱溶液的pH 取两片pH试纸,放在白瓷板上,分别用玻璃棒蘸取稀氢氧化钠溶液,将试纸显示的颜色与 比较,读出pH. |
/ |
若实验过程中,用沾有水的玻璃棒蘸取溶液,则所测得的pH (填“>”、“=”或“<”)实际值 |
(2)碱和指示剂作用取两只洁净的试管,分别加入约2mL的稀氢氧化钠溶液,澄清石灰水,再分别加入3滴无色酚酞溶液,观察溶液颜色变化. |
两只试管汇中的酚酞溶液均变为 色 |
稀氢氧化钠溶液、澄清石灰水都呈 性. |
(3)碱和非金属氧化物的反应用排水法收集一瓶呼出的气体,然后加入约2mL澄清石灰水,振荡,观察现象 |
澄清石灰水变浑浊 |
反应的化学方程式
|
在粗盐提纯过程中,将氯化钠溶液蒸发至有较多固体析出后,应 ,并用玻璃棒不断搅拌,利用余热将余下水分蒸干.
氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如图

(1)推测草酸的化学式是 ;
(2)“沉锌”过程中发生复分解反应,反应的化学方程式是
(3)“操作A”的名称是 ; 实验室常用的研磨仪器是 ;
(4)“高温灼烧”时草酸锌分解,反应的化学方程式是 。
如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。

请回答:
(1)应称量 gNaCl,需加水 mL。
(2)若称量NaCl固体时指针向右偏转,则应 直到天平平衡。
(3)取上述溶液10g加水稀释到 g,可得到5%的NaCl溶液。
《四川盐法志》记载,“敞锅熬盐”主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,析出粗盐;③用“花水”冲洗粗盐得精品盐。
(1)步骤①中,黄卤所含杂质BaCl2和黑卤所含杂质MgSO4反应生成白色沉淀。该反应的化学方程式为 。
(2)步骤②中,析出粗盐的过程称为 。
(3)步骤③用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl.则“花水”应当是 (填标号)。
A.蒸馏水 B.饱和NaCl溶液 C.饱和NaOH溶液 D.饱和BaCl2溶液
(4)将60kg含10%NaCl的黄卤和40kg含15%NaCl的黑卤混合,经“敞锅熬盐”制得的粗盐中NaCl的质量最多为 kg。
(1)化学小组选用下图装置制取并收集氧气.
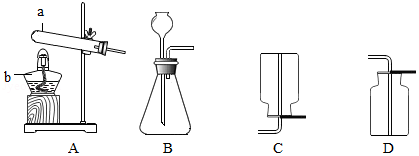
①仪器的名称:a是 ,b是 .
②实验室制取氧气的化学方程式为 (写一个),实验时对应的气体发生和收集装置分别是 (填标号,下同)和
(2)碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质.化学小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2═2K2CO3+2I2
乙:4KI+O2+2H2O═4KOH+2I2
Ⅱ.KOH与NaOH的化学性质相似.
为探究碘化钾变质原理的合理性,开展以下实验.
[实验过程]
[实验1]取适量碘化钾固体暴露于空气中一端时间,观察到固体泛黄,往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊.
①石灰水变浑浊的原因是 (用化学方程式表示)
②化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论.理由是 .
[实验2]
按如图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象.
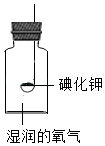
③据此现象,可得出的结论是 .
[实验3]
按如图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象.
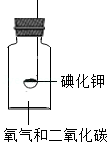
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行.
化学小组据此改进实验,很快观察到固体泛黄的现象.
④简述化学小组改进实验的具体措施 .
[实验结论]
⑤根据上述实验,化学小组得出结论:碘化钾固体泛黄变质是碘化钾与 共同作用的结果.
农业废弃物是指农业生产过程中废弃的有机物,如秸秆、蔗渣等.
(1)农业废弃物经发酵处理可获得沼气(主要成分为甲烷).甲烷完全燃烧的化学方程式为 .
(2)闽籍科学家张俐娜发明了一种快速溶解农业废弃物的“神奇溶剂”.该“神奇溶剂”中氢氧化钠、尿素和水的质量比为7:12:81.
①“神奇溶剂”是一种溶液,其溶质有 .
②某次生产需用到100kg“神奇溶剂”.现仅用氢氧化钠溶液和尿素来配制,所用的氢氧化钠溶液的溶质质量分数为 (列出计算式即可).
③利用该“神奇溶剂”溶解农业废弃物生产的新型纤维素膜,在土壤中能完全降解.利用此膜替代普通塑料,可缓解的环境问题是 (写一点)
化学兴趣小组在老师的帮助下围绕燃烧实验开展相关研究。
探究一:氢气的燃烧实验

(1)用锌和稀硫酸制取氢气,从图1中选择仪器组装一套随开随停的发生装置,所需仪器为 (填编号);仪器B的名称是 。
(2)按图2操作研究氢气的燃烧实验,需用试管收集不同体积比的氢气与空气的混合物,现用(1)中组装的正确装置制取氢气,如何用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,写出其操作方法: 。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
| 序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 氢气与空气体积比 |
9:1 |
8:2 |
7:3 |
5:5 |
3:7 |
1:9 |
0.5:9.5 |
| 点燃现象 |
安静 燃烧 |
安静 燃烧 |
弱的 爆鸣声 |
强的 爆鸣声 |
强的 爆鸣声 |
弱的 爆鸣声 |
不燃烧 不爆鸣 |
分析上表信息,你对燃烧或燃烧条件的新认识是 。
探究二:可燃性粉尘燃烧剧烈程度的影响因素
(4)用如图3装置研究某可燃性粉尘颗粒大小对燃烧剧烈程度的影响,燃烧剧烈程度用燃烧产生的最大压力衡量,容器内壁的传感器可测出燃烧产生的最大压力。
①实验过程中需改变的实验条件是 ,不能改变的是 、 、 (仅列三种);
②实验测得可燃性粉尘颗粒大小与燃烧产生的最大压力的关系如图4所示,其原因是 。

(5)兴趣小组另测得可燃性粉尘浓度与燃烧产生的最大压力的关系如图5所示,结合图5信息,提出防止可燃性粉尘发生燃烧的合理建议:①禁止烟火;② 。