已知:将SO2通入FeCl3溶液中,溶液颜色会变为浅绿色,其原理可表示为:
□Fe3++ □SO2+ □H2O —— □Fe2++ □SO42-+ □H+
(1)在上述方框内填上配平后的系数,并用单线桥法标出电子转移的方向和数目。
(2)若参加反应的SO2体积为1.12 L(标准状况下),则反应中转移电子的物质的量为____ mol;
(3)已知向Fe2+溶液中滴加少量硝酸时,溶液由浅绿色变为黄色。则Fe3+、SO42-、HNO3的氧化性由强到弱的顺序为_________ 。
某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则加入的检验试剂依次分别是 (写化学式);写出最后检验出的离子与所加试剂反应的离子方程式 。
现有五种溶液,分别含下列离子:①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+。
(1)写出符合下列条件的离子符号:
滴加氯水有明显现象的离子是 ,加铁粉后溶液增重的是 ;
(2)向③的溶液中滴加NaOH溶液,现象是 ,反应过程中属于氧化还原反应的化学方程式 。
已知硫酸在水中的电离方程式是:H2SO4 = H+ + HSO4— HSO4— H++SO42—,回答下列问题:
H++SO42—,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”)。理由是(用离子方程式表示) 。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的有 。
| A.c(SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 |
| B.c(OH-)=c(H+)+c(HSO4—) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)=2c(SO42—)+2c(HSO4—) |
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO42—)="0.029" mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO42—) 0.029 mol·L-1(填“<”,“>”或“=”),理由是 。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是: 。
(5)如果25 ℃时,0.10 mol·L-1H2SO4溶液的pH="-lg" 0.11, 则25 ℃时,0.10 mol·L-1的H2SO4溶液中c(SO42—)= 。
向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
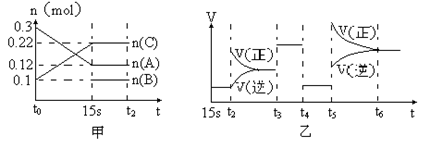
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体 g。
(1)在该溶液的配制过程中,用到的玻璃仪器: 、胶头滴管、量筒、烧杯、玻璃棒。
(2)如果在定容时仰视,溶液浓度将 ;若定容时液面高于刻度线应采取的措施是 。
Ⅱ、取上述实验中配制的NaOH溶液100mL,缓慢通入一定量的CO2,充分反应,测得最后溶液呈碱性。
(1)此时溶液的溶质若是单一成分,可能是 或 。
(2)若果在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示。
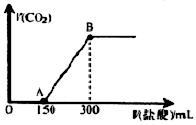
①由图可知,碱性溶液中的单一溶质为 。
②请写出0-A段所发生反应的离子方程式 。
③B点时,产生的CO2在标准状况下的体积为 mL;B点时,反应所得溶液中溶质的物质的量浓度是 mol/L(两种溶液混合时体积可以直接相加)。
(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是 ,属于电解质的是 。(填编号)
(2)现有:①铝、②二氧化硅、③二氧化硫、④二氧化碳、⑤三氧化二铁、⑥氢氧化钠、⑦氢氧化镁、⑧氢氧化铝、⑨氢氧化铁,能形成酸雨的是________;光纤制品的基本原料是__________;属于两性氢氧化物的是___________;红棕色固体是_____________。(填编号)
(3)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于 效应。
(4)胃舒平是治疗胃酸(盐酸)过多的常用药物。其中含有的有效成分是氢氧化铝,其治疗原理是(用化学方程式表示): ;碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式 。
NaHCO3是一种酸式盐,其水溶液显碱性,是重要的化工产品和化学试剂。
(1)NaHCO3俗称 ,其水溶液显碱性的原因是(用离子方程式表示) 。
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式___________________________。
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出。
①倒置灭火器时发生反应的离子方程式是___________________________;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液。你认为此建议_______(填“合理” 或“不合理”),理由是__________________。
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2 g |
15.7 g |
27.6 g |
| V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
①该混合物中NaHCO3的物质的量分数为 ;
②所用盐酸的物质的量浓度是 mol·L-1。
H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。
(1)写出H2O2在MnO2催化下分解的化学方式 。
(2)在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是 。
(3)实验室使用酸性KMnO4标准液测定溶液中H2O2的浓度。
①酸性KMnO4溶液应盛放在__________(填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是 。
②完成并配平离子方程式:□MnO4-+□H2O2+□H+ = □Mn2++□O2↑+□ ,在反应中H2O2作 剂(填“氧化”或“还原”),每生成1mol O2,转移电子 mol。
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:_______________。反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
(1)分别用等体积的蒸馏水和0.01mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。原因是
(请结合平衡移动原理,用相关的化学用语及文字表述回答。)
(2)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol/L时,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol/L时,溶液的pH应调至
(3)实验证明,多元弱酸的分步电离一步比一步困难。原因是
(提示:可以从粒子的电荷情况和电离平衡的移动两方面加以考虑)
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液是 (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=
Ⅰ.对某星球外层空间取回的气体样品分析如下:
①将样品溶于水,发现其主要成分气体A极易溶于水, 水溶液呈酸性;
②将A的浓溶液与KMnO4反应产生一种黄色气体单质B,将B通入石灰乳可生成两种钙盐的混合物D;
③A的稀溶液与锌粒反应生成气体C,C和B的气体充分混合经光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。
据此回答下列问题:
(1)化学式:A___________;C_____________;
(2)气体B与Ca(OH)2反应的化学方程式_______________________。
Ⅱ.双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N元素表现为-3价),化学方程式为:KCN+H2O+H2O2=KHCO3+A↑(已配平)
(3)生成物A的化学式为____________,该反应中的氧化剂____________;
(4)若将KCN改为HCN也类似上述反应,则该反应的化学方程式为____________。
Ⅰ.二氧化锰是化学工业中常用的氧化剂和催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)  MnO(s) + CO2(g) ②2MnO(s) + O2(g)
MnO(s) + CO2(g) ②2MnO(s) + O2(g)  2MnO2(s)
2MnO2(s)
(1)反应①达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 。(填字母序号)
| A.平衡常数减小 | B.MnCO3质量不变 | C.CO2压强不变 | D.MnCO3物质的量增加 |
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某温度下,该平衡体系的总压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,则碳酸锰热分解总反应的化学平衡常数Kp= (提示:用含P、n1、n2 的字母表达, 分压 = 总压×物质的量分数)
Ⅱ. 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液与烟气中SO2反应可制备MnSO4·H2O。
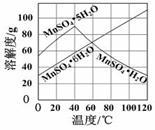
(4)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10‾39,pH =7.1时Mn(OH)2开始沉淀,pH =9.4时Mg(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+( 欲使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______________________。
(5)由右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 Ⅰ. 。Ⅲ. 二氧化锰也是电化学的重要材料。
(6)碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O ="=" 2MnOOH + Zn(OH)2,该电池正极的电极反应为 。
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为______________________。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2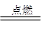 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为______________________。
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。
Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。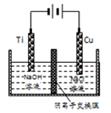
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:
N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。
(1)实验室中常用来制备氨气的化学方程式为 。
(2)已知H2(g)的燃烧热为285.8kJ•mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式 _。
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________________(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为_____________mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)。
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2 ]:CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
30 |
70 |
80 |
100 |
| n(CO2)/mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20min时v正(CO2)_________80min时v逆(H2O)(填“>”、“=”或“<”)。在t℃时,该反应的平衡常数K= 。
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将_________(填“增大”、“不变”或“减小”)。
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是 (填图甲中的“A”或“B”)。
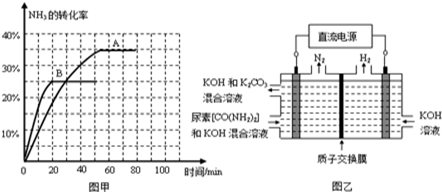
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气。该装置中阳极的电极反应式为______ ,若两极共收集到气体22.4L(标况),则消耗的尿素为______g(忽略气体的溶解)。