Ⅰ.H2SO4的摩尔质量为 ;0.3mol的CO(NH2)2中含有 个电子(用NA表示);
Ⅱ.①标准状况下22.4 L CH4 ②1.5 mol NH3 ③1.806 x1024个H2O④标准状况下73g HCl所含H原子个数由多到少的顺序为 (填序号);在含0.4 mol Al2(SO4)3的溶液中SO42—的物质的量为 ;
Ⅲ.某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是 ;该气体在一定条件下可与氢气反应生成氨气,试写出该反应的化学方程式 ;
Ⅳ.取100 mL a mol / L HCl溶液与300 mL n mol / L H2SO4溶液均注入到500 mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+ 的物质的量浓度为 mol / L;
由基本有机化工原料A(C2H2)制备有机物D和聚异戊二烯的合成路线如下图所示:

完成下列填空:
(1).上述转化步骤中与反应①的反应类型相同的是 (填编号)。
(2).m与n的关系为 。
(3).异戊二烯分子中最多有 个原子共平面。
(4).在异戊二烯的同分异构体中,与A具有相同官能团且分子中有支链的有机物的名称是 。
(5).参照流程图中异戊二烯的合成路线,若把步骤⑤中的反应物丙酮改为乙醛,则经过反应⑤、⑥、⑦后得到的有机物是 。
工业上制取纯硅的主要反应:SiCl4 + 2H2  Si + 4HCl。该反应中,被还原的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1molSi,则转移电子 mol,消耗H2 mol。
Si + 4HCl。该反应中,被还原的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1molSi,则转移电子 mol,消耗H2 mol。
材料是人类赖以生存和发展的重要物质基础,铁和碳是生活中常见的材料。
(1)碳可用于制取水煤气:C(s)+H2O(g)=CO(g)+H2(g)。相同温度下,在体积均为2L的两个密闭容器(已加入足量的碳)中进行上述反应,反应容器分别用编号A、B表示。
①写出该反应的平衡常数的表达式:
②已知该温度下平衡常数K="1.5" mol·L-1,若向A容器中另加入一定量的水蒸气,经过一段时间后达到平衡,此时c(H2O)=0.1mol·L-1、c(CO)=0.5mol·L-1,则c(H2)= mol·L-1。
③若向B容器中再加入一定量的水蒸气,某一时刻测得体系中物质的量如下:n(H2O)=0.2mol、n(CO)=0.2mol、 n(H2)=0.8mol则此时该反应
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(2)钢铁在海水中常发生电化学腐蚀,其负极反应式为 ;
(3)利用右图装置,可以模拟铁的电化学防护,为减缓铁的腐蚀,若开关K置于b处则Fe应与电源的 极相连。若开关置于a处,则下列可用作X极材料的是 。
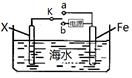
A.Zn B.Cu C.石墨 D.Pt
除杂质:所选试剂都填化学式
(1) 除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 。
(2) 除去FeCl2溶液中混入的FeCl3溶液杂质用试剂是 ,离子方程式为 。
(3)除去Mg粉中混有的少量Al杂质的试剂是 ,离子方程式为 。
(4)除去NaHCO3溶液中混有的少量Na2CO3 杂质的试剂是 ,离子方程式为 。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是 。C60和金刚石都是碳的同素异形体,二者比较熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据下表数据,写出B的基态原子的电子排布式 。
| 电离能/(kJ·mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色。如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
(1)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①上述两种解释中________(填“甲”或“乙”)正确。
②为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
③若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知25 ℃时CH3COONH4溶液呈中性)
(2)有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙同学在制得的Mg(OH)2沉淀中加入浓CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
甲同学的解释为:因为NH4Cl溶液中,NH4++H2O NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s) Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
乙同学的解释为:因为CH3COONH4===CH3COO-+NH4+,且Mg(OH)2(s) Mg2+(aq)+2OH-(aq),NH4++OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
Mg2+(aq)+2OH-(aq),NH4++OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
你认为哪一位同学的解释是正确的?________,为什么?____________________。
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为__________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率,α(A)的表达式为______________。平衡时A的转化率为_______,列式并计算反应的平衡常数K______________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h |
0 |
4 |
8 |
16 |
| c(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10-1 |
1.7×10-5 |
6.2×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=____________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 ________(填字母)。
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段
两种溶液产生CO2气体的速率存在明显差异的原因是________________________。
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,

则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是:_________________________。
稀释相同倍数后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是______________________________;
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。
(7)写出少量CO2通入次氯酸钠溶液中的离子方程式________________________。
人体血液里存在重要的酸碱平衡:CO2+H2O H2CO3
H2CO3 HCO3-+ H+,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-+ H+,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-) ∶c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
| pH |
6.10 |
7.35 |
7.40 |
7.45 |
试回答:
①正常人体血液中,HCO3-的水解程度________电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3)________c(HCO3-) (填“<”、“>”、“=”)
④等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为____________________。
(2) ①已知25 ℃时, CO32-水解反应的平衡常数(即水解常数)Kh= =2×10-4 mol·L-1,则HCO3-的电离平衡常数是Ka2=________,当溶液中c(HCO3-)︰c( CO32-)=2︰1时,溶液的pH=________;
=2×10-4 mol·L-1,则HCO3-的电离平衡常数是Ka2=________,当溶液中c(HCO3-)︰c( CO32-)=2︰1时,溶液的pH=________;
②0.1 mol·L-1 Na2CO3溶液中c(OH-)-c(H+)=________[用 c(HCO)、 c(H2CO3)的关系式表示]。
在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
化学在环境保护中起着十分重要的作用。催化反硝化法可用于治理水中硝酸盐的污染。催化反硝化法中,H2能将NO3-还原为N2。25 ℃时,反应进行10 min,溶液的pH由7变为12。
(1)N2的结构式为__________。
(2)上述反应离子方程式为_________,其平均反应速率v(NO3-)为_______mol·L-1·min-1。
(3)还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法_________________。
常温下,10 mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示。
请回答下列问题:
(1)在图中用曲线表示将10 mL pH=2的盐酸加水稀释到1000 mL的过程中溶液pH变化趋势。
(2)物质的量浓度均为0.1 mol·L-1的NaX和NaY溶液,pH较小的是________,其中水的电离程度较大的是________。
(3)常温下,0.1 mol· L-1的HY溶液中加入等体积pH=1的盐酸后,溶液的pH_______(填“升高”或“降低”),HY的电离程度________(填“增大”、“减小”或“不变”)。
(4)H2Z是一种二元弱酸,常温下,0.1 mol·L-1的H2Z溶液中加入等体积pH=13的KOH溶液后,溶液的pH<7,原因可能是__________________________。
H3PO2是一元中强酸,写出其电离方程式_______________________。
NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”、“中性”或“弱碱性”)。
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| |
冷轧含锌 废水水质 |
经处理后的水国 家环保标准值 |
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
| SO42-浓度/(mg·L-1) |
≤23 000 |
≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为________mg·L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),________(填“符合”或“不符合”)国家环保标准。