.含CuSO4和H2SO4的混合溶液200mL,其中CuSO4物质的量浓度为1mol.L-1, H2SO4物质的量浓度为0.5mol.L-1,若用此溶液配成0.2mol.L-1 CuSO4和2mol.L-1 H2SO4的混合溶液,试求:
(1)所得溶液的体积是多少毫升?
(2)需加入密度为1.84g.cm-3、98%的浓硫 酸多少毫升?
酸多少毫升?
某抗酸药每片含碳酸钙534 mg,氢氧化镁180 mg,每片该药可中和多少克溶质的质量分数为6.2%的盐酸?(保留到 0. 01 g )
某抗酸药每片含碳酸钙534 mg、氢氧化镁180 mg。试计算10片该药片理论上可与1. 00 mol·L-1的盐酸溶液多少毫升恰好反应?
用98%的浓H2SO4(ρ=1.84g/cm3)配制成1.84mol/L的稀H2SO4 500ml,计算所需浓H2SO4的体积。(注意:要求写出简单的计算步骤。)
0.5 mol H2SO4的质量是 g , 其中含有 gH、 mol S、 个O。
将0℃、101KPa条件下的HCl气体44.8L,通入500ml水中(已知水的密度为:1.00g/ml),得到密度为1.13g/ml的盐酸(即氯化氢的水溶液)。
(1)求此盐酸中溶质的物质的量浓度? (计算结果保留一位小数)
(2)在此盐酸中加入250ml氢氧化钡溶液恰好完全反应,计算氢氧化钡溶液中OH-的物质的量浓度?
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 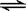 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴ 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

① 该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
② 从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:
。
⑵ 将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
① 写出H2O2发生的化学反应方程式 _______________ ______。
② 实验结果说明催化剂作用的大小与________ _________有关。
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
把5.1 g镁铝合金的粉末放入过量的300 mL 2 mol·L-1盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝和镁的物质的量之比。
(2)在反应后的溶液中加入4 mol·L-1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是
2P+5H2SO4(浓)==2H3PO4+5SO2↑+2H2O
若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目。
(2)计算生成的SO2在标准状况下的体积。(写出计算过程)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
请回答下列问题:
(1)求参加反应的二氧化锰的质量。
(2)求反应中被氧化的HCl的物质的量。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,求该浓盐酸中HCl的物质的量浓度。
常温下,要将质量分数为10%的氯化钠溶液100g变为质量分数为20%的氯化钠,常用的方法有加入溶质和蒸发溶剂。请通过计算回答:
⑴需要加入氯化钠晶体 g。
⑵需要蒸发掉 g水。