下列制备和收集气体的实验装置合理的是
A. 用锌粒和稀硫酸制H2 用锌粒和稀硫酸制H2 |
B. 用H2O2和MnO2制O2 用H2O2和MnO2制O2 |
C. 用氯化铵和氢氧化钙固体制NH3 用氯化铵和氢氧化钙固体制NH3 |
D. 用铜片和稀硝酸制NO 用铜片和稀硝酸制NO |
下列有关NaHSO3溶液的叙述正确的是
| A.该溶液中,K+、Ca2+、Cl2、Br—可以大量共存 |
| B.能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |
| C.与FeCl3反应的离子方程式:SO32—+2Fe3++H2O = SO42—+2Fe2++ 2H+ |
| D.和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH—+ HSO3—= CaSO3↓+H2O |
阿伏加德罗常数用NA表示,下列说法中正确的是
| A.1 mol CH3+(碳正离子)中含有质子数为8NA |
| B.标准状况下,22.4 L溴单质所含原子数目为2NA |
| C.常温下,100mL lmol.L﹣l盐酸与4.6 g钠反应生成H2分子数目为0.1 NA |
| D.密闭容器盛有0.1 mol N2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6 NA |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
Fe3+有氧化性 |
Fe 2(SO4)3可作净水剂 |
| B |
浓硫酸有腐蚀性 |
常温下浓硫酸不能用铁罐盛装 |
| C |
Cl2是非金属单质 |
Cl2能使湿润的有色布条褪色 |
| D |
熔融状态的NaCl中有自由移动的Na+和Cl- |
电解熔融状态的NaCl制备Na |
下列溶液中微粒的物质的量浓度关系一定正确的是
| A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) |
| C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-) |
已知一定条件下:A2B5(g)  A2B3(g)+B2(g) A2B3(g)
A2B3(g)+B2(g) A2B3(g)  A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
| A.0.1mol/L | B.0.2mol/L | C.0.9mol/L | D.1.5 mol/L |
有关下列图像的分析错误的是
A.图①可表示对平衡N2(g)+3H2(g)  2NH3(g)加压、同时移除部分NH3时的速率变化。
2NH3(g)加压、同时移除部分NH3时的速率变化。
B.图②中a、b曲线只可表示反应H2(g)十I2(g)  2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况。若2<a<5,则两酸都为弱酸
D.图④中的y可表示将0.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况
恒温、恒压下,将1 mol O2和2 mol SO2气体充入一个体积可变的容器中(状态Ⅰ) ,发生反应:2SO2(g)+O2(g) 2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:
2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:
| A.60% | B.40% | C.80% | D.90% |
下列有关水电离情况的说法正确的是
| A.25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同 |
| B.其它条件不变,稀释醋酸钠溶液,水的电离程度增大 |
| C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小 |
| D.其它条件不变,温度升高,水的电离程度增大,Kw增大 |
下列叙述正确的是
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
下列离子方程式书写正确的是
A.用Pt电极电解少量的MgCl2溶液:2H2O+2Cl- H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| B.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| C.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O |
| D.FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+= Fe3++4H2O |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.与AlCl3溶液反应的离子方程式为 Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+) ﹥ c(HCO3-) ﹥ c(CO32-) ﹥ c(H2CO3) |
| B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-) – c(H+) = c(HCO3-) + c(H2CO3) |
| C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液: c(CO32-) ﹥ c(HCO3-) ﹥ c(OH-) ﹥ c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)="0.1" mol·L-1]: |
c(Na+)= c(CH3COO-)> c(CH3COOH)>c(H+)=c(OH-)
如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和1mol O2,乙中充入4 mol SO3和1mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3(g)  2SO2(g)+ O2 (g)。下列有关说法正确的是
2SO2(g)+ O2 (g)。下列有关说法正确的是
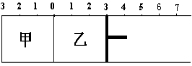
| A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲 |
| B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度: c(SO3)乙>2c(SO3)甲 |
| C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ(SO2)乙>2ψ(SO2)甲 |
| D.若活塞固定在7处不动,达平衡时两容器中SO3的物质的量分数相等 |