用10mL的0.1mol/L BaCl2溶液恰好可使相同体积的硫酸铝、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A.3:2:2 | B.1:3:3 | C.2:3:6 | D.3:1:1 |
氮化铝(AlN)具有耐高温.抗冲击,导热性好等优良性质,被广泛应用于电子工业.陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C  2AlN + 3CO下列叙述正确的是( )
2AlN + 3CO下列叙述正确的是( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 |
| B.氮化铝是铝合金中的一种 |
| C.上述反应中每生成2molAlN,N失去6mol电子 |
| D.氮化铝中氮元素的化合价为-3 |
下列实验过程中出现的异常情况,其可能原因分析错误的是( )
| 选项 |
异常情况 |
可能原因分析 |
| A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B |
分液:分液漏斗中的液体难以滴 下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
| D |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A.Cu2+、 H+、 Cl﹣ | B.K+、OH﹣、CO32﹣ |
| C.CO32﹣、OH﹣、Cl﹣ | D.K+、H+、Cl﹣ |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )


下列说法正确的是( )
| A.二氧化硅溶于水显酸性 |
| B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 |
| C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
| D.二氧化硅是酸性氧化物,它不溶于任何酸 |
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |
下列物质的溶液中分别滴加Ba(OH)2溶液至过量,反应产生的沉淀的质量(m)或物质的量(n)随加入的Ba(OH)2溶液体积关系图像正确的是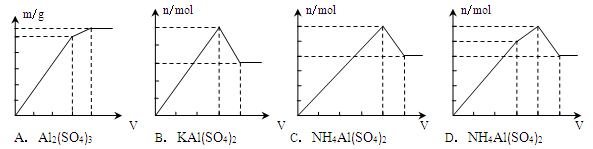
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.c中颜色变化说明AgCI 转化为AgI |
| C.实验可以证明AgI比AgCI更难溶 |
| D.滤液b中不含有Ag+ |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)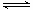 N2O4 (g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是
N2O4 (g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是

A. > >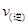 |
B. < <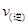 |
C. = =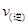 |
D. 、 、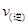 大小关系不确定 大小关系不确定 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+3、+5、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z从其氢化物中置换出来
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,锌失去电子,电解液内部OH-向负极移动 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
| A.②③④ | B.①②③④⑤ | C.①④⑤ | D.①②③ |