常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A.18gD2O和18gH2O中含有的质子数均为10NA |
| B.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2 NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
“保护环境,就是保护人类自己。”下列环境问题与产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“厄尔尼诺”现象是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
⑦“赤潮”主要是由水体中P、N等元素过量引起的
| A.只有①② | B.只有②③⑤ | C.全部 | D.只有③ |
将一定量的锌与浓度为18.5mol/L的100mL浓硫酸充分反应后,锌完全溶解,同时生成26.88L标准状况下的气体,反应后测得溶液中氢离子浓度为1.0mol/L,则生成的气体的物质的量之比为
| A.n(SO2)/n(H2)=1/1 | B.n(SO2)/n(H2)=4/1 |
| C.n(SO2)/n(H2)=1/4 | D.n(SO2 )/n(H2)=3/2 |
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、I-、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.1L0.1mol/L该溶液和足量的Cu充分反应,离子方程式为Cu+2Fe3+=Cu2++2Fe2+ |
| D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是
| A.质子质量 | B.质量 | C.密度 | D.原子总数 |
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③Cl2+H2O = H++Cl-+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-=AgCl↓
| A.只有③ | B.②③ | C.③⑤ | D.①④ |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
向AlCl3溶液中加入过量的NaOH溶液,过滤,洗涤,干燥,加热 |
制取Al2O3 |
| B |
将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水 |
检验气体产物中的CO2 |
| C |
分别向等量的A、B两种白色粉末中,加入等体积、等浓度的稀盐酸 |
区分Na2CO3、NaHCO3两种固体 |
| D |
将S02通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 |
验证亚硫酸的不稳定性 |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH,下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中NaClO是氧化剂 |
| C.Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| D.若有2molFeCl3发生反应,转移电子的物质的量为6mol |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 |
| B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性 |
| C.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤NaHSO4 ⑥AlCl3 ⑦NaAlO2
| A.①⑤ | B.②③④⑥⑦ | C.①②③④ | D.全部 |
下列反应中,能证明SiO2是酸性氧化物的是
①SiO2+4HF=SiF4↑+2H2O ②SiO2+CaO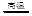 CaSiO3
CaSiO3
③SiO2+2NaOH=Na2SiO3+H2O ④SiO2+2C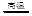 Si+2CO↑
Si+2CO↑
| A.①② | B.②③ | C.③④ | D.①④ |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体,现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色,对于原混合气体成分的判断中正确的是
| A.肯定有NO和NO2 | B.肯定有SO2和NO |
| C.可能有Cl2和O2 | D.肯定没有Cl2、NO2,可能有O2 |
下列叙述中正确的是
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2CO3和NaHCO3溶液都与CaCl2溶液反应得到白色沉淀③钠在常温下不容易被氧化④Na2O2可作供氧剂,而Na2O不行⑤除去Na2CO3固体中混有的NaHCO3,将混合物加热至质量不再发生变化⑥可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验
| A.②③④⑤ | B.④⑤ | C.②④⑥ | D.①②⑥ |
下列说法不正确的是
| A.温度相同、体积相同的O2(g)和N2(g)分子数相同 |
| B.等温等压下,SO2气体与CO2气体的密度之比等于16:11 |
| C.温度和容积相同的两气罐中分别盛有5molO2(g)和2molN2(g),两容积中的压强之比等于5:2 |
| D.等温等压条件下,5molO2(g)和2molH2(g)的体积之比等于5:2 |