稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域。一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如下: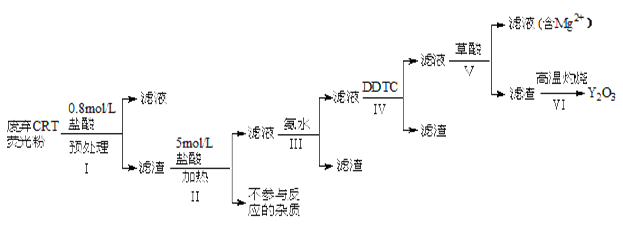
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如下表所示;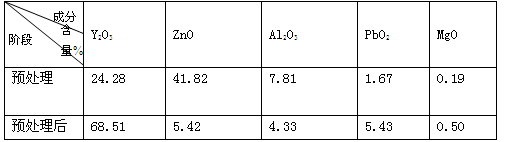
②不同离子沉淀的pH如图所示。
(1)步骤I中进行原料预处理的目的为_____________。
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为_______________。
(3)步骤Ⅲ中发生的主要反应的离子方程式为_______________。
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有______,其不能通过直接加碱的方法除去,原因为_____。
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于_______mol/L。
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-28)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为___________。
(12分)工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为amL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
④ (填入该步反应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积______(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 (该实验条件下的气体摩尔体积为Vm L)。
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用下图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系。
实验测得数据和有关结果如下:
①准确称得无水硫酸铜 2.4 g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112 mL;
③干燥管在实验后质量增加1.28 g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质)。
请回答下列问题:
(1)装置B的作用是 ;发生的化学方程式________________________。
(2)装置C的作用是__________________;干燥管收集到的物质是__________ 。
(3)实验数据测出后,计算出氧气的物质的量有________mol;并据此计算出SO2为_________mol,SO3为___________mol。
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来滴定氢氧化钠的的浓度,反应如下:KHC8H4O4 + NaOH = KNaC8H4O4 + H2O。若氢氧化钠的溶液浓度为0.1mol·L-1,到达终点时,溶液的pH约为9.1。
(1)为标定氢氧化钠溶液的浓度,应选 用作指示剂,达到滴定终点时溶液由 色变为 色。
(2)在测定氢氧化钠溶液浓度时,有下列操作:
①向溶液中加入1-2滴指示剂
②向锥形瓶中加20-30ml蒸馏水溶解
③用氢氧化钠溶液滴定到终点,半分钟不褪色
④重复以上操作
⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250ml锥形瓶中
⑥根据两次实验数据计算氢氧化钠的物质的量浓度。
以上各步中,正确的(填序号)操作顺序是
(3)上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响?
并说明理由:
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果 (填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH 20 mL,则NaOH溶液的浓度为 (结果保留四位有效数字)。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是( )
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 |
| B.坩埚 |
| C.表面皿 |
| D.泥三角 |
E.酒精灯
F.干燥器
(2)步骤⑤的仪器名称是 ;
(3)步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(4)若反应后有Mn2+步骤④反应的离子方程式是 。
(5)步骤⑤中,某学生选择用苯来提取碘的理由是 。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
注:NH4Fe(SO4)2是一种复盐。请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为_________________________。
(2)检验TiO2·x H2O中Cl-是否被除净的方法是_________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_______(填字母代号)。
(4)滴定终点的现象是__________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗C mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为___________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__ __。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为 。
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是 。
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
| 实验操作 |
预期现象 |
结论 |
| |
|
假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式 。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c mol•L-1 Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为 。由测定数据可求得该样品中含KIO3的质量分数为 (用含m、c、V的代数式表示,Mr(KIO3)=214 )。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质。以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示。
已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O  2CrO42- + 2H+。
2CrO42- + 2H+。
请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有 (填化学式)
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式 。
(2)“焙烧”过程中,所产生X气体的电子式为 。
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条): ; 。
(4)滤渣1的主要成分是 。若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式 。
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质 (填化学式)的含量。
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是 、 、过滤、75%乙醇水溶液洗涤、干燥。
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。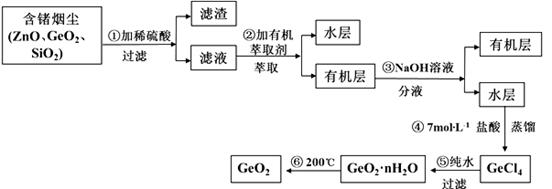
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有 (填化学式),实验室萃取操作用到的玻璃仪器有 。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为 。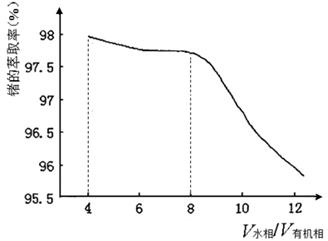
(3)第④步加入盐酸作用 (答两点即可)。
(4)第⑤步反应的化学方程式 。
(5)检验GeO2·nH2O是否洗涤干净的操作是 。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为0.105mol,则该样品中GeO2的物质的量为_____ mol。
(本题16分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如上表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是(写化学式) 。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,ⅰ、4Al(s)+3O2(g) 2Al2O3(s) ΔH1=-a kJ/mol
2Al2O3(s) ΔH1=-a kJ/mol
ⅱ、4V(s)+5O2(g) 2V2O5(s) ΔH2=-b kJ/mol
2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2V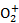 +H2C2O4+2H+
+H2C2O4+2H+ 2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。此时装置C中发生的现象是 。
(2)反应进行到A中不再产生气泡时,拆除C、D装置后,为了使A中固体全部消失,①接下来的操作是:______________________________。
②该过程中发生反应的离子方程式是 ;
③为使A中固体加快溶解速率,以下方法运用合理的是 。
a. 对A装置加热
b. 向A内加入少量Fe2O3
c. 向A内加入少量CuO
d. 增大空气通入量
e. 向A内加入少量FeSO4
f. 向A内加入少量H2O
(3)待A中固体全部溶解后,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是 __________。
(4)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应。
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ,因为 。
(2)写出甲酸进行银镜反应的化学方程式 。
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作 (写字母)
| A.用洁净试管 |
| B.在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银 |
| C.用前几天配制好的银氨溶液 |
| D.在银氨溶液里加入稍过量的甲酸 |
E.用小火对试管直接加热
F.反应过程中,振荡试管使之充分反应
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
(4)乙装置中长导管A的作用是 。
(5)写出甲酸和甲醇进行酯化反应的化学方程式 。
(6)选择甲装置还是乙装置好? ,原因是 。
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有 、 两种必备用品。
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释 。
某混合碱是①Na2CO3和NaHCO3或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n(Na2O)]进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol•L-1的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第I次滴定的第一个终点的液面如图所示,请读出实验数据,填入下列表格中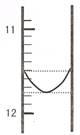
| 序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
| I |
|
26.85 |
| II |
10.02 |
25.02 |
| III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计 。
现用盐酸标准溶液来测定NaOH溶液的浓度。滴定时有下列操作:
①向溶液中加入1~2滴指示剂。
②取20.00 mL标准溶液放入锥形瓶中。
③用氢氧化钠溶液滴定至终点。
④重复以上操作。
⑤配制250 mL盐酸标准溶液。
⑥根据实验数据计算氢氧化钠的物质的量浓度。
(1)以上各步中,正确的操作顺序是________________________________(填序号),上述②中使用的仪器除锥形瓶外,还需要_____________,使用________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如下表:
| 滴定次数 |
1 |
2 |
3 |
4 |
| V(标准溶液)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)/mL(初读数) |
0.10 |
0.30 |
0.00 |
0.20 |
| V(NaOH)/mL(终读数) |
20.08 |
20.30 |
20.80 |
20.22 |
| V(NaOH)/mL(消耗) |
19.98 |
20.00 |
20.80 |
20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为
V(NaOH) =  mL =" 20.02" mL
mL =" 20.02" mL
他的计算合理吗? 。理由是 。
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a 20.02(填“>”“<”或“=”)。
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值。通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该组同学设计了如下滴定方法测定x的值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到反应终点时消耗了10.00mL;
请回答:
(1)滴定时,将KMnO4标准溶液装在图中的 (选填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是 。
(3)通过上述数据,可计算出x= 。
(4)若滴定终点时俯视滴定管刻度,则由此测得的x值会 (选填“偏大”、“偏小”或“不变”,下同)。若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。