现用盐酸标准溶液来测定NaOH溶液的浓度。滴定时有下列操作:
①向溶液中加入1~2滴指示剂。
②取20.00 mL标准溶液放入锥形瓶中。
③用氢氧化钠溶液滴定至终点。
④重复以上操作。
⑤配制250 mL盐酸标准溶液。
⑥根据实验数据计算氢氧化钠的物质的量浓度。
(1)以上各步中,正确的操作顺序是________________________________(填序号),上述②中使用的仪器除锥形瓶外,还需要_____________,使用________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如下表:
| 滴定次数 |
1 |
2 |
3 |
4 |
| V(标准溶液)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)/mL(初读数) |
0.10 |
0.30 |
0.00 |
0.20 |
| V(NaOH)/mL(终读数) |
20.08 |
20.30 |
20.80 |
20.22 |
| V(NaOH)/mL(消耗) |
19.98 |
20.00 |
20.80 |
20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为
V(NaOH) =  mL =" 20.02" mL
mL =" 20.02" mL
他的计算合理吗? 。理由是 。
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a 20.02(填“>”“<”或“=”)。
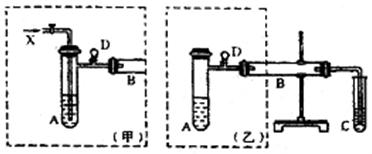
 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
 __。
__。 ____________________________________________________________。
____________________________________________________________。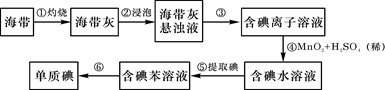
 ,进行了如下探究活动:
,进行了如下探究活动: 粤公网安备 44130202000953号
粤公网安备 44130202000953号