中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组测定某葡萄酒中SO2含量。步骤如下:
(1)取300.00 mL葡萄酒,加入适量盐酸,加热使SO2全部逸出
(2)逸出的SO2被稍过量的H2O2完全吸收氧化
(3)加热(2)中溶液,除尽过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,以酚酞为指示剂,滴定到终点,记录消耗NaOH溶液的体积
(4)重复上述操作2~3次
试回答:(1)步骤2中H2O2氧化SO2的化学方程式为__________________________。
(2)NaOH标准溶液用 滴定管(填“碱式或酸式”)盛装。
(3)到达滴定终点时,溶液由 色变为_____ ___色,且半分钟内不再变化;
(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处,则管内液体的体积(填序号)________(①=10.00 mL,②=40.00 mL,③<10.00 mL,④>40.00 mL)。
(5)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为______g·L-1
(6)以下操作使所测得的SO2含量偏高的是
A.滴定前,未用NaOH标准溶液润洗滴定管
B.滴定前滴定管内无气泡,终点读数时有气泡
C.滴定前仰视读数,滴定终点时读数正确
铁是人类目前使用最多的金属,可以形成多种氧化物。某实验小组欲利用氢气还原法测定某铁的氧化物(FexOy)的组成,根据实验内容回答下列问题:
I.定性分析:氧化物中铁元素的价态
(1)取适量该氧化物溶于过量的 (填“稀硫酸”、“稀盐酸”或“稀硝酸”),取少量溶液分别装入两支洁净的试管甲、乙中。甲试管中加入高锰酸钾溶液,乙试管中加入硫氰化钾溶液,能证明该氧化物中同时含有Fe2+、Fe3+的现象是: 。
II.定量分析:氧化物的组成
(2)按各部分仪器在该实验中的作用分析:装置E中盛放的药品是 ,作用是 。
(3)实验装置用上面所列仪器组成,按氢气流向的连接顺序是(括号中填入接口字母):
a→( )→( )→( )→( )→( )→( )→( )→( )→( )
(4)实验前,将该铁的氧化物放在坩埚内低温烘焙,这样做的目的是: ,若缺少此步骤,会导致x : y (填“偏大”、“偏小”或“无影响”)。
(5)称取烘焙后样品3.04 g,与氢气充分反应后生成水0.9 g,则该样品的组成为: 。
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。为了测定RX的分子量,实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀。
④过滤、洗涤、干燥后称重,得到固体c g。回答下面问题:
(1)装置中长玻璃管的作用是_______________________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的____________离子。
(3)该卤代烷中所含卤素的名称是_________,判断的依据是____________。
(4)该卤代烷的分子量是_________(用含a、b、c的式子表示)。
(5)在步骤②中,如果加HNO3的量不足,则步骤④中测得的c值______。
| A.偏大 | B.偏小 | C.不变 | D.大小不定 |
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
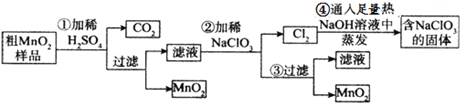
按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3-______MnO2(填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________。
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是 。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是____________(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
(本题共12分)阿司匹林( )是世界上应用最广泛的解热、镇痛药。因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药。因乙酸很难与酚羟基酯化,工业上以水杨酸( )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林。粗产品中主要的副产物是水杨酸多聚物,需进一步提纯。反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林。粗产品中主要的副产物是水杨酸多聚物,需进一步提纯。反应原理和相关物理数据如下:
| 名称 |
常温下状态 |
水中溶解性 |
| 乙酸酐 |
液 |
与水反应 |
| 阿司匹林 |
固 |
冷水中微溶;热水中易溶 |
| 水杨酸多聚物 |
固 |
难溶 |
下图是工业上制备并提纯阿司匹林的部分流程:
完成下列填空:
37.步骤①的反应装置如图所示(加热装置未画出),实验仪器必须干燥的原因是_____________;冷凝管的作用是___________;对烧瓶进行加热的合适方法是____________。
38.反应中加入的乙酸酐是过量的,过量的目的是_____________;步骤②中加入水的目的是使乙酸酐转化为乙酸,同时放出大量的热,需冷却至常温再进行过滤,冷却的目的是______;检验步骤③所得滤液中是否含有水杨酸,可选用的试剂是______(写化学式)。
39.步骤④中加入NaHCO3的目的是_________________。
40.步骤⑤过滤得到的滤渣主要是_____________。步骤⑥中加入盐酸后发生反应的化学方程式为______。
41.从步骤⑥到成品纯阿司匹林的剩余操作依次有_____________________。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺的流程如下: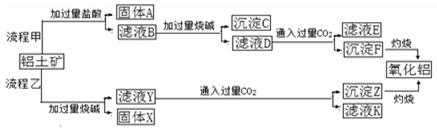
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为____________________________.
(2)流程乙加入烧碱后生成SiO32—的离子方程式为______________________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是_________(填化学式),写出该溶液的一种用途__________
(5)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10—12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________________.
B.[实验化学]茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华。另外茶叶中还含有11% ~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿。现从茶叶中提取咖啡碱流程如下:
步骤I:称取一定量的茶叶,放入下图所示提取器的滤纸筒中,在圆底烧瓶中加入95%乙醇,用水浴加热,连续提取1.5小时。
步骤Ⅱ:待冷凝液刚刚虹吸下去时,立即停止加热。稍冷后,改成蒸馏装置,回收提取液中的大部分乙醇。
步骤Ⅲ:趁热将瓶中的残液倾入蒸发皿中,拌入3 ~ 4g生石灰粉使成糊状,低温蒸干,并压碎块状物。
步骤Ⅳ:取一只口径合适的玻璃漏斗,罩在隔以刺有许多小孔滤纸的蒸发皿上,小心加热升华,控制温度在180℃左右。当滤纸上出现大量白色毛状结晶时,停止加热,使其自然冷却,收集升华所得咖啡因。
回答下列问题:
(1)实验之前需要将茶叶研磨成粉末状,其目的是 。
(2)溶解抽提时不选择氯仿直接将咖啡碱提取而选用乙醇的原因是 。
(3)提取器中虹吸管的作用是 。
(4)冷凝器中冷却水从 进 出(选填“a”或“b”)。
(5)生产过程中可循环使用的物质是 。
(6)在粗产品中加入生石灰的原因是 。
(1)下列与化学实验有关的描述错误的是_______ (填序号)。
①燃着的酒精灯不慎碰翻失火,可立即用湿布盖灭
②分液时分液漏斗中的下层液体从下口流出,上层液体从上口倒出
③锥形瓶用作反应容器时一定不能加热
④浓硝酸与浓盐酸均易挥发,故均应保存在棕色试剂瓶中,并置于阴凉处
⑤不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
⑥称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为9.5g。
(2)某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。
回答下列问题:
(2)①该实验过程中,多次用到玻璃棒,如过滤时引流液体、灼烧时搅拌防止固体崩溅,试写出该实验过程中玻璃棒的第三个作用 。
②验证滤液A含Fe3+,可取少量滤液并加入____________ (填试剂名称)。
③实验中,该小组同学用下图装置进行过滤操作,过滤操作中的一处错误是 。
④在灼烧操作时用到下列仪器中的 (填字母代号),其名称是 。
(4分)为测定含有Na2O杂质的Na2O 样品的纯度,甲同学设计以下的方案。
样品的纯度,甲同学设计以下的方案。
用图所示装置,通过测定Na O2与C0
O2与C0 反应生成0
反应生成0 的体积来测定样品的纯度。
的体积来测定样品的纯度。
(1)C中所盛的药品是____________
(2)A中橡皮管的作用是____________
(3)利用该实验方案所测Na O
O 的纯度明显偏大,其原因可能是__________ (填选项字母)。
的纯度明显偏大,其原因可能是__________ (填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左低右高
d.读数时U形量气管中的液面左高右低
(4)该法步骤相对麻烦,请设计一种简便的实验方法完成实验目的,画简图说明即可。
试回答下列中和热测定的有关问题
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验用品是________________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒(填“能”或“不能”)__________,其原因是______________________________________________。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为20℃,终止温度为23.2℃。试计算该反应的中和热ΔH=_________。
(15分)CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% |
5 |
10 |
15 |
20 |
25 |
30 |
| CaO2/% |
62.40 |
63.10 |
63.20 |
64.54 |
62.42 |
60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:____。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是____。
(3)加入KI溶液后发生反应的离子方程式为____。
(4)请补充完整实验步骤4中的内容:____________;____________。
Ⅲ.测定含有CaO杂质的CaO2含量的实验方法较多,某同学设计了仅用稀盐酸一种药品(仪器可任选)较为准确地测出CaO2含量的实验,请你帮该同学列出所需仪器清单(实验用品和用于固定的或连接的仪器可不写)。
(5)仪器:________________________。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。

第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0. 010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是 。抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是 ,滴定终点溶液的颜色呈 色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是 。
(4)1kg卷心菜中所含维生素C相当于 片上述维生素药片。(用含V1、V2的代数式表示)
)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
(1)工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品, ,搅拌。
② 。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3, ,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(2)Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:

(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O Al(OH)3 + OH— ,
Al(OH)3 + OH— ,
“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。
【改编】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
(1)第①步,向铝土矿中加入足量烧碱溶液后,Al2O3发生反应的离子方程式是_______________;固体B是_________;第②步中,涉及到的离子方程式___________________、____________________;
(2)第③步中,生成氢氧化铝最好选用下列试剂中__________试剂(填序号)
| A.二氧化碳 | B.氨气 |
| C.氢氧化钠溶液 | D.盐酸 |
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)