(每小题2分,共14分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL的容量瓶中定容成250mL烧碱溶液; |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始时的刻度数为V1mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点时消耗酸的体积为V2mL。
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)
________→________→________→____D____→________;
(2)滴定管读数应注意 ___________________。
(3)操作E中在锥形瓶下垫一张白纸的作用是 _________________。
(4)操作D中液面应调整到 ,尖嘴部分应 。
(5)滴定终点时锥形瓶内溶液的pH约为 ,终点时溶液颜色的变化是 。
(6)若酸式滴定管没有用标准H2SO溶液润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”)(其他操作均正确)。
(7)该烧碱样品的纯度计算式是 。
某学生为了测定部分变质的Na2SO3样品的纯度。按图2所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。回答下列问题:
(1)写出A装置(图1)中玻璃仪器的名称:酒精灯、_____________、_____________。
(2)实验开始后,应先点燃____________处酒精灯(填装置字母)。
(3)实验开始后,写出B中反应的离子方程式____________________________。
(4)C中的现象是________________,E装置的作用是________________________。
(5)原样品中Na2SO3的纯度为_____________(精确到0.1%)。按题给装置和操作进行实验,若装置连接和实验操作均无任何问题,该学生测得的Na2SO3的纯度____________(填“偏高”、“偏低”或“无影响”)。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。可用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为__________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是_____________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________________;
使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。
(4)滴定终点的现象是____________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样W g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为__________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
50 mL 0.50 mol・L-1盐酸与50 mL 0.55 mol・L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
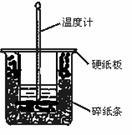
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验改用60 mL 0.50 mol・L-1盐酸跟50 mL 0.55 mol・L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol・L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤.取滤液;③蒸发滤液;④冷却结晶.为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等分:
①取一份溶液,加入适量HCl,观察到 ,证明含有碳酸根
②取另一份溶液,为检验SO42﹣,应往溶液中先加入过量的 ,再加入BaCl2溶液.
③取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl﹣.你认为所得的结论是否严密? 理由是
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:

已知:i.Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii.Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii.KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3
溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、
碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4 H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
请回答下列问题:

(1)检验装置A气密性良好的方法是
(2)从左到右连接装置的顺序是:A→ ;
(3)证明CO存在的实验现象是 ;
(4)本实验尾气处理的方法是 。
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq) Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器有 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用常见试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
(12分)某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。

(1)写出装置A中发生反应的化学方程式: 。
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和 ;
假设二:存在三种成分: NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3: |
|
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O+NaCl NaHCO3↓+NH4Cl ;2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)氨气、二氧化碳与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g,以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
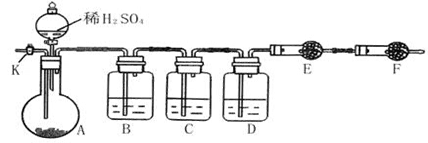
(1)将仪器连接好以后,必须进行的第一步操作是_____________。
(2)此实验还必须用到的最重要的仪器是 ;仪器F的作用是 。
(3)已知仪器C中装有品红溶液,其作用是________ _ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是 。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为__________。
(10)实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。
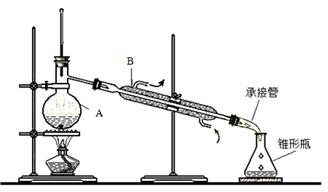
请回答下列问题:
(1)仪器A和B的名称分别是 , 。
c(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。
(12分) 硝酸钾样品中含有少量碳酸钾、硫酸钾和难溶于水的杂质。提纯硝酸钾的实验时
先将硝酸钾样品溶于适量水中,充分搅拌后过滤,然后将滤液按下图所示步骤进行操作。

回答下列问题:
(1)你认为起始滤液中所含离子浓度最大的是 ,其理由是 。
(2)试剂I的化学式为 ,①中发生反应的离子方程式为 。
(3)②中加入试剂Ⅱ的目的是 ;试剂Ⅲ的名称是 ,
③中发生反应的离子方程式为____ 。
(4)由E溶液得到KNO3晶体需要____、____、过滤、洗涤、干燥、称量。若得到的晶体质量小于理论产量,其可能原因是 。
(5)为检验C固体的化学成分,A同学用盐酸溶解wg C固体,等完全反应后测得生成的CO2在标准状况下的气体体积为V mL。B同学将wg固体C灼烧至质量不再变化为止,冷却后称量剩余固体质量为bg。从化学定量实验的准确性原则来看,你认为 同学更加合理。
在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出1.12L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为3.6g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在 ,若存在求其最小浓度,若不存在说明理由 。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

(1)将仪器连接好以后,必须进行的第一步操作是_____________。
(2)此实验还必须用到的最重要的仪器是_______;仪器F的作用是_______。
(3)已知仪器C中装有品红溶液,其作用是________ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是_____。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_________。