铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
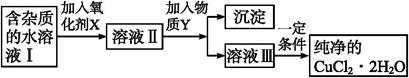
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 最适合作氧化剂X的是 (填编号,否则不给分)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂X的目的是 。
(3)为了除去Fe3+,需加入物质Y调节溶液的PH值为
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)已知Fe(OH)3的Ksp=1×10-35mol4/L4;若Fe3+沉淀完全时,在溶液中Fe3+的浓度为1×10-5mol/L,则此时溶液的pH最小为 .
硫酸亚铁晶体(FeSO4•7H2O)在医药上常作补血剂,某课外研究小组测定该补血剂中铁元素的含量,其实验步骤如下:

请回答下列问题:
(1)证明操作Ⅰ滤液中含有Fe2+的方法之一是向滤液中加入NaOH溶液,现象为 ,步骤Ⅱ中发生反应的离子方程式为 .
(2)写出步骤Ⅳ中一系列处理的操作步骤:过滤、 、灼烧、 、称量.
(3)若实验无损耗,则每片补血剂中含铁元素 g.
(4)该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定.
①该实验原理用离子方程式可表示为 .
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 .
③该实验中的KMnO4溶液需要酸化,用于酸化的酸是 .
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
④若取m g该补血剂用0.1mol•L﹣1的KMnO4溶液进行滴定,在此实验过程中共用去KMnO4溶液100mL,则该补血剂中铁元素的质量分数为 .
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
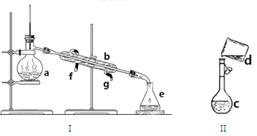
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
实验题组
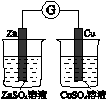
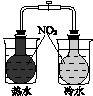
Ⅰ.下图所示的实验,能达到实验目的的是 。
| A |
B |
C |
D |
 |
 |
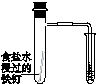 |
 |
| 验证化学能 转化为电能 |
验证温度对化学平衡的影响 |
验证铁 发生析氢腐蚀 |
验证AgCl 溶解度大于Ag2S |
Ⅱ.某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式: ;
(2)检验吸收液中SO42–的方法: ;
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 |
(1) 若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立。 |
| 步骤2: |
|
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(1)第①步反应的化学方程式为 ________。
(2)生产中可循环使用的物质是 。
(3)检验CaO2•8H2O是否洗净的方法是 ________________ 。
(4)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
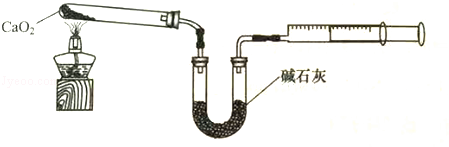
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有 ______ 。
海水开发利用的部分过程如图所示。下列说法错误的是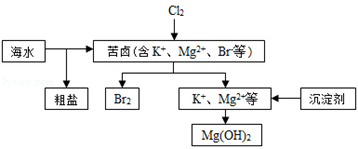
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂、过滤、蒸发结晶等过程提纯 |
| C.工业生产常选用NaOH作为沉淀剂 |
| D.单质溴可用SO2将其还原吸收 |
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
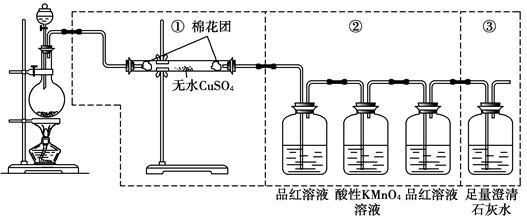
(1)装置中①、②、③可以检验出的物质是① ____,②____________,③_____________。
(2)浓硫酸与木炭粉反应的化学方程式:____________________。
(3)②中第一瓶品红溶液的作用是_________________,第二瓶品红溶液的作用是_________________,酸性KMnO4溶液的作用是__________________。
(4)证明产生的气体中含有CO2的现象是:___________________。
(1)用天平称取________g NaOH配制500 mL 2.0 mol·L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是 。
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是 。
分别用一种试剂将下列物质中的少量杂质除去(括号内为混入的杂质)。
| 物 质 |
需加入的试剂 |
有关离子方程式 |
| HNO3(HCl) |
|
|
| ZnSO4(CuSO4) |
|
|
| NaCl(Na2CO3) |
|
|
实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。

请回答下列问题:
(1)仪器A和B的名称分别是 , 。
(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是 。
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。
实验室里需要纯净的溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:

根据以上设计方案,回答下列问题:
(1)操作①和⑤的方法分别是 、 ;
(2)操作②是否可改为加硝酸钡溶液?为什么? ,(填是或否)理由: 。
(3)操作②后,如何判断SO42-已除尽,方法是 。
(4)操作③的目的是 ;
(5)操作④加的试剂是 ;发生反应的离子方程式为: 。
有一包从海水获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
探究一:这包粗盐中还有什么杂质?估计还含有氯化钙和氯化镁。
(1)现用实验验证推测:取样并溶解,加入几滴氢氧化钠溶液,目的是检验有没有___________________,接着再加数滴碳酸钠溶液,目的是检验有没有____________________。实验证明含有的杂质是氯化钙。
探究二:这包粗盐中氯化钠的质量分数是多少?接下面步骤继续实验:
①称取一定质量样品;
②将样品加水溶解;
③向粗盐溶液加入过量的某种试剂,过滤;
④沉淀洗涤后小心烘干,得到纯净固体A;
⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;
⑥称量实验中得到的某种固体。
(2)在②③⑤的步骤中,都使用到的同一仪器是____________,它在步骤②和⑤的操作方法相同,但目的不同,在步骤②的目的是_____________________,步骤⑤的目的是________________。
(3)在步骤③中加入的试剂是________________
(4)步骤⑥中,你认为需要称量的固体是A还是B____________
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)______________.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_____________,____________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______________.
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体应是(填化学式)____________.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为_____________,请设计实验检验所得溶液中溶质的阴离子______________.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图实验装置回答问题

(1)写出下列仪器的名称:① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的是 (填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 ,将仪器补充完整后进行的实验操作的名称为 ;②的进水口是 (填“f”或“g”)。
(4)现需配制250 mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误之处:① ;② 。