某同学设计如下实验验证炭与浓硫酸的反应产物及产物的某些性质。
(1)装置A中盛放浓硫酸的仪器名称是 。
(2)若要证明有水生成,需要在A、B之间加装盛有 的干燥管。
(3)利用装置B可以完成的实验是 。
(4)若在E中盛装澄清石灰水,C中盛装酸性高锰酸钾溶液,则D中的试剂是 ,其作用是 ;写出C中关于高锰酸钾发生反应的离子方程式 。
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
(1)实验仪器A的名称为 。
(2)装置C中浓硫酸的作用是 。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为 。
(4)该实验方案存在明显缺陷,会使测定结果 (填“偏高”或“偏低”)。为使结果准确,你的建议是 。
苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其它食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,制备流程为:
操作步骤如下:① 将一定量的甲苯和碱性KMnO4溶液加热至沸腾,并冷凝回流至混合液不再分层。② 反应停止后,将反应混合液过滤,滤渣为黑色固体;得到的滤液如果呈紫色,可加入少量的饱和亚硫酸钠溶液使紫色褪去,重新过滤。③ 将②中所得滤液经一系列操作得到苯甲酸晶体。
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;
(1)该实验合成苯甲酸钾可能用到的下列仪器有__________。
A.圆底烧瓶 B.蒸馏烧瓶 C.冷凝管 D.温度计
(2)第①步中被回流的主要物质是____________________。
(3)写出滴加饱和亚硫酸钠溶液时的离子方程式______________________________。
(4)步骤③得到苯甲酸晶体应进行操作是________(按操作顺序填正确答案序号)。
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(12分)金属单质及其化合物在生产生活中应用非常广泛,废旧金属的回收利用是重要研究课题。某学习小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的A1,Fe及其氧化物)生产胆矾,其实验方案如下:
(1)上述流程中,操作1所得“滤液’‘的主要成分为_____________;
(2)酸溶后所得溶液中的榕质主要有_____________;
(3)请写出酸溶过程单质铜发生反应的离子方程式___________;该反应中氧化剂与还原剂的物质的量之比为______________;
(4)试剂可以是________________;
(5)操作3是一系列操作.其操作为______________、冷却结晶、过滤、___________、小心干燥。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式: .
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: .
(3)浓硫酸的作用是:① ;② .
(4)饱和碳酸钠溶液的主要作用是 .
(5)实验中加热小试管的目的是:① ;② .
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 .
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 .
下列实验不合理的是 ( ) 
| A.证明非金属性强弱S>C>Si | B.四氯化碳萃取碘水中的碘 |
| C.制备并收集少量NO气体 | D.制备少量氧气 |
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5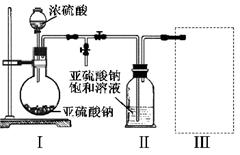
(1)装置Ⅰ中产生气体的化学方程式为 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下: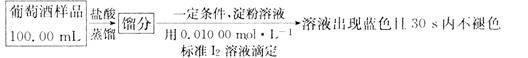
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
(1)沉淀A的主要成分是 (填化学式)。
(2)②中反应的离子方程式是 。
(3)①②③中均进行的分离操作是 。
(4)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是 ,为了除去杂质,可向溶液3中加入适量的 。
(5)实验室用上述实验获得的NaNO3固体配制500 mL 0.40 mol/L NaNO3溶液。
①配制溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;j.称量。称取NaNO3固体的质量是 g。
按照操作顺序,第4步是 (填序号)。
②某同学转移溶液的操作如图所示,该同学操作中的错误是 。
③若用胶头滴管定容时,不小心滴水滴过了刻度线,你认为应该采取的处理方法是: 。
④下列操作中,可能造成所配制溶液的浓度偏低的是 (填选项)。
a.没有洗涤烧杯和玻璃棒
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组同学设计了如下实验流程(所加试剂均为足量)。
 请回答:
请回答:
(1)亚硫酸盐作为食品添加剂的作用是 (填字母)。
a.防腐保鲜 b.增强营养
(2)反应①中通入N2的目的是 (填字母)。
a.冷却产生的气体
b.与生成的气体反应
c.将生成的气体全部赶出
(3)反应①~③中属于氧化还原反应的是 (填序号)。
(4)若取样品X g,反应③消耗0.01 mol/L NaOH溶液100 mL,则1 kg样品中含SO2的质量是 g(用含X的代数式表示)。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图中Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________________。
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)_______;
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管A中装入的固体最好是(填化学式)________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为_________________________;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为______,请设计实验检验所得溶液中溶质的阴离子___________。
(1)下列有关实验操作或判断不正确的是 。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
E.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察.
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| |
试剂 |
离子反应方程式 |
| ①NaHCO3溶液(Na2CO3) |
|
|
| ② Fe2O3(Al2O3) |
|
|
| ③FeCl3溶液(FeCl2) |
|
|
| ④CO2(HCl) |
|
|
海洋植物中含有丰富的碘元素,实验室从海藻中提取碘的流程如下图所示:
(1)写出提取碘的过程中有关的实验操作名称:① ;③ 。写出操作③使用的所有玻璃仪器名称 ,并从下列选项中选出合理的提取用试剂 。
A.酒精 B.四氯化碳 C.醋酸 D.汽油
(2)写出操作②中有关反应的离子方程式: ,有同学从绿色化学的角度出发提出用H2O2代替Cl2,试说明他的理由 。(提示:H2O2+2I-+2H+ = I2+2H2O)
(3)操作③分离出来的废液中含有Cl-、SO42-,现只取一次试液,为了鉴别出Cl-、SO42-,从下列选项中选出依次加入的试剂:足量的 、 。
A.盐酸酸化的氯化钡 B.硝酸酸化的硝酸银
C.硝酸酸化的硝酸钡 D.硝酸酸化的氯化钡
(4)后期处理采用的是蒸馏操作,装置如图所示,
涉及物质的一些物理性质如下表:
| 物质 |
密度/g·cm-3 |
熔点/℃ |
沸点/℃ |
| 晶态碘(I2) |
4.933 |
113.7 |
184.3 |
| 某有机溶剂 |
1.584 |
-22.92 |
76.72 |
根据上述信息判断,下列说法正确的有 。
A.装置图中温度计水银球的位置错误
B.装置图中冷凝水的流向错误
C.仪器A的名称是圆底烧瓶,仪器B的名称是冷凝管
D.蒸馏结束,晶态碘聚集在锥形瓶中
Ⅰ、为探究CO2与NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
(1)请写出CO2与过量NaOH溶液发生反应的离子方程式: 。
(2)选择任意一种装置进行实验,简述产生的实验现象。选择的实验装置是 (填“甲”或“乙”或“丙”),实验现象是 。
(3)上述实验中,如果二氧化碳过量,还可能生成 (写化学式),写出生成此物质的离子反应方程式 。
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如下图,大试管A与小试管a相连通,大试管B小试管b相连通。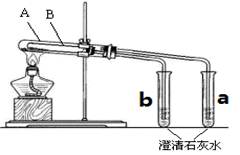
(4)则小试管B中应装的药品是 (写化学式)。
(5)加热过程中,对于a、b试管内溶液是否出现浑浊现象的描述正确的是 。
A.仅a试管溶液变浑浊
B.仅b试管溶液变浑浊
C.a、b试管中的溶液都会变浑浊。
某小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。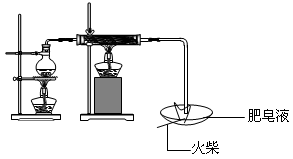
反应一段时间,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当 时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 。
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。写出有关的化学方程式:
(3)向滤液中滴加KSCN溶液,观察到溶液的颜色有两种可能,如下表。在下表中填写与现象相对应的结论与解释(可以不填满)。
| |
现象 |
结论与解释 |
| 可能① |
溶液由浅绿色变红色 |
|
| 可能② |
溶液仍然为浅绿色 |
|
(4)可能①中,若要使红色又变成浅绿色,又不增加其它的金属离子,可以加入 ,可能②中,加入 可以使溶液变成红色。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?___________。简述你的理由_____________________________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。
写出实验过程中发生反应的离子方程式_____________________、___________________________、________________________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________________。