为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验: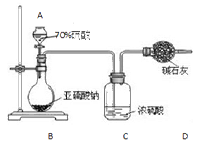
(1)实验仪器A的名称为 。
(2)装置C中浓硫酸的作用是 。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为 。
(4)该实验方案存在明显缺陷,会使测定结果 (填“偏高”或“偏低”)。为使结果准确,你的建议是 。
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
(1)实验仪器A的名称为 。
(2)装置C中浓硫酸的作用是 。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为 。
(4)该实验方案存在明显缺陷,会使测定结果 (填“偏高”或“偏低”)。为使结果准确,你的建议是 。