期中备考总动员高三化学模拟卷【江苏】7
下列叙述正确的是
| A.强电解质溶液的导电性不一定比弱电解质溶液的导电性强 |
| B.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| C.若测得雨水的pH小于7,则下的是酸雨 |
| D.在通风橱中进行有毒气体实验符合“绿色化学”思想 |
下列表述正确的是
| A.16O与18O互为同位素;H216O与H218O互为同素异形体 |
B.次氯酸分子的电子式为 |
C.S2-的结构示意图: |
| D.天然橡胶单体的名称:2-甲基-1,3-丁二烯 |
【改编】室温下,下列各组离子在指定溶液中能大量共存的是
| A.c(OH-)/c(H+)=1010的溶液:K+、Fe3+、Cl-、NO3- |
| B.c(H+)=1.0×10-13mol/L溶液中 : C6H5O-、K+、SO42-、Br- |
| C.澄清透明的无色溶液:NH4+、K+、MnO4-、SO42- |
| D.pH=12的溶液中 : NO3-、I-、Na+、Al3+ |
【原创】关于氮及其化合物的叙述正确的是
| A.N2分子中含有3个π键 |
B.常温常压下,密闭容器中2NO2 N2O4该反应达到平衡时,气体颜色不再改变 N2O4该反应达到平衡时,气体颜色不再改变 |
| C.足量的稀HNO3与5.6gFe反应生成标准状况下H22.24L |
| D.NO2、NO气体可以用向上排空气法收集 |
下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
| A.装置A中圆底烧瓶中可以换成固体MnO2 |
| B.如果直接加热MgCl2•6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO |
| C.尾气吸收可以用浓硫酸作为吸收剂进行吸收 |
| D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火 |
【改编】下列说法正确的是
| A.35Cl和36Cl原子所含质子数不同 |
| B.0.1 mol 盐酸溶液与足量的铁粉反应,转移的电子数为0.3mol |
| C.常温常压下3.5 g的35Cl2气体的体积为2.24 L |
| D.1 mol/L的氯化铁溶液和3mol/L的氯化钠溶液中,氯离子浓度相等 |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O ="=" Cu(OH)2↓+ 2H+ |
| C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-= NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
【原创】下列对SO2的叙述中,正确的是
| A.所有的非金属氧化物都是酸性氧化物,所以SO2是酸性氧化物 |
| B.SO2可以使高锰酸钾溶液褪色,说明SO2具有漂白性 |
| C.煤的燃烧会产生SO2气体,进而形成酸雨 |
| D.SO2是一种无色有臭鸡蛋气味的有毒气体 |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大。X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层电子数与其电子层数相等,Z—与M2+具有相同的核外电子层结构。下列推测正确的是
| A.原子半径Y>Z,离子半径Z—<M2+ |
| B.MX2与水发生反应时,MX2只做氧化剂 |
| C.X、Y形成的化合物既能与强酸反应又能与强碱反应 |
| D.MX2、MZ2两种化合物中,都含有离子键和共价键,且阳离子与阴离子个数比均为1:2 |
已知热化学方程式:
(1)2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化有下列描述:①放出;②吸收;③2.44 kJ;④4.88 kJ;⑤88 kJ。其中正确的是
| A.②和⑤ | B.①和③ | C.②和③ | D.②和④ |
已知某可逆反应aA(g) + bB(g) cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的
| A.正反应为吸热反应 |
| B.降低温度,正反应速率增大 |
| C.a + b < c + d |
| D.增大压强,B转化率增大 |
【原创】下列有关有机物的说法正确的是
A.1mol 能 与2molNaOH充分反应 能 与2molNaOH充分反应 |
B. 系统命名法为3-丁烯 系统命名法为3-丁烯 |
C. 的碳原子都在一个平面内,且它的二氯取代物为3种 的碳原子都在一个平面内,且它的二氯取代物为3种 |
D.1mol 可以与4molH2发生加成 可以与4molH2发生加成 |
【改编】氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,关于BrCl叙述错误的是
| A.固态溴化碘是由极性键构成的分子晶体 |
| B.跟水反应的化学方程式为BrCl+ H2O =" HCl+" HBrO |
| C.BrCl氧化性强于Cl2 |
| D.与水反应时BrCl既是氧化剂又是还原剂 |
下列说法正确的是
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
| B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如上图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系:Kw ·K = Ka |
在容积固定为4L的密闭容器中,进行了可逆反应:X(g)+2Y(g) 2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示
2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示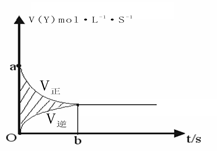
| A.X浓度的减少 |
| B.X物质的量的减少 |
| C.Z浓度的增加 |
| D.Y物质的量的减少 |
【改编】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
(1)第①步,向铝土矿中加入足量烧碱溶液后,Al2O3发生反应的离子方程式是_______________;固体B是_________;第②步中,涉及到的离子方程式___________________、____________________;
(2)第③步中,生成氢氧化铝最好选用下列试剂中__________试剂(填序号)
| A.二氧化碳 | B.氨气 |
| C.氢氧化钠溶液 | D.盐酸 |
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
(10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1;由②可知存在的离子为 ,浓度是 mol·L-1;由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为____________;Ⅳ中发生反应的化学方程式为____________________;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ——Ⅳ—II—Ⅴ——Ⅵ,此时Ⅱ中现象为_____,原因是____________________________________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M,则A的化学式为__________。
(10分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ、查阅资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅱ、牙膏样品中碳酸钙的定量测定:
利用下图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

实验步骤:
①如上图所示连接好装置,先检查装置的气密性;
②准确称取牙膏样品的质量4.00g,并在各仪器中加入相应试剂;
③打开弹簧夹甲,缓缓通入空气,然后接上C;
④打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
⑤待B中不再产生气体后停止滴加盐酸;
⑥将C中沉淀过滤、洗涤、干燥,得BaCO3;
⑦称量BaCO3的质量为1.97g。
依据实验过程回答下列问题:
(1)步骤④通过空气的作用有:______________ __、___ __________。
(2)步骤⑥中检验沉淀洗干净的方法是 。
(3)本实验测定得到的样品中碳酸钙的质量分数为 。若采取下列措施,对测定结果的准确度没有影响的是_____________(填标号)。
a.省略步骤③
b.滴加盐酸快一些
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.多次实验,取平均值计算
(4)有同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数。请你说明是否可以并简要说明理由 。
(12分)【化学一物质结构与性质】已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_ ______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式_______.
(5)D2B的晶胞如图所示,已知晶体的密度为  ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含 、
、 的式子表示)。
的式子表示)。
将0.1 mol的镁、铝混合物溶于100 mL,2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH 溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,则金属粉末中n(Mg)=____________mol,n(Al)=____________mol,V2=____________mL。

(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a ,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号