(1)某澄清透明溶液,可能含有下列离子:Fe3+ 、K+、Ba2+、Al3+、NH4+、Cl-、NO3-、SO42-。现做以下实验:
①取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀。
②另取溶液,逐滴加入NaOH溶液至过量,只看到有红棕色沉淀生成且沉淀质量不减少。
由此可以推断:溶液中肯定存在的离子有 ;溶液中肯定不存在的离子有 ;溶液中不能确定是否存在的离子有 ;
(2)制备Fe(OH)2时,向FeSO4溶液中滴加NaOH溶液时,滴管尖端的位置是 _ ;原因是: 。
用于分离或提纯物质的方法有:A 蒸馏(分馏) B 盐析C 过滤 D 重结晶 E 升华 F 渗析 G 加热分解。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(把选用的方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒( )
(2)除去Fe(OH)3胶体中混有的Cl-离子( )
(3)除去乙醇中的少量水( )
(4)除去氧化钙中的碳酸钙( )
(5)除去固体碘中混有的砂子( )
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物。

填空和回答下列问题:
(1)B物质是 (写化学式)。
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中第 步(填序号)设计存在 问题,这一步的正确设计方案应是 ;有关反应的离子方程式为 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是_____________。
从下列实验方法中,选出最适宜的方法并将其序号填在横线上。
A 蒸发结晶 B 重结晶 C 分液 D 蒸馏 E 过滤 F 萃取分液 G 渗析
① 除去粗盐中的泥沙② 除去硝酸钾中的氯化钠
③ 分离水和汽油的混合物④ 从碘水中提取碘
⑤ 除去淀粉溶液中的NaCl⑥ 从食盐水中获取NaCl
⑦ 分离水和丙酮的混合物(丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC)
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。
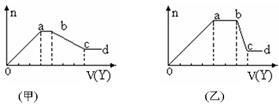
(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
某无色透明溶液中可能大量存在下列离子中的几种:Na+、Mg2+、Ca2+、Fe2+、Cu2+、OH-、Cl-、CO32-、HCO3-、NO、SO42-。请填写下列空白:
(1)不做任何实验就可以肯定溶液中不存在的离子是 ;
(2)取少量原溶液滴加几滴酚酞试液,溶液变红色。此实验现象可说明原溶液中肯定不存在的离子是 ;
(3)另取少量原溶液逐滴滴加盐酸至过量,无气体、无沉淀生成,再加入BaCl2溶液后,有白色沉淀生成。此实验现象可说明原溶液中肯定不存在的离子还有 ;
(4)将(3)实验所得混合液静置,取少许上层清液并加入AgNO3溶液,有白色沉淀生成。
根据上述实验推断:原溶液中肯定存在的离子有______________,不能肯定存在的离子有___________。
溴被称为“海洋元素”,海水中的溴主要以NaBr的形式存在。查阅资料得知:Br2的沸点为59℃,微溶于水,易溶于有机溶剂。实验室简单模拟从海水(此处以低浓度的NaBr溶液代替)中提取溴单质的流程如图:

(1)写出实验操作的名称,操作① 、操作② ;
(2)在富集过程中,有反应 5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A.2NaBr+Cl2 = 2NaCl+Br2
B.2H2S+SO2 = 2H2O+3S↓
C.AlCl3+3NaAlO2+6H2O = 4Al(OH)3↓+3NaCl
D.Cl2 + 2NaOH =" NaCl" +NaClO + H2O
(3)实验前检测分液漏斗没有问题,但在操作①的步骤中,旋开分液漏斗下端的旋塞,却发现分液漏斗中的液体很难滴下,其原因可能是 ;
(4)下列说法正确的是 。
A.操作①中,可以用酒精代替CCl4
B.操作②中,若发现忘了加碎瓷片,应该趁热补加
C.操作②中,温度计水银球应浸没在蒸馏烧瓶中液体的液面以下,但不能接触瓶底
D.操作②中,冷凝水流向应该是下进上出
(1)按要求填空:①液态SO3②BaCO3固体 ③酒精 ④盐酸 ⑤汞 ⑥NaCl晶体 ⑦纯醋酸 ⑧水,能导电的是 (填编号,下同),属于电解质的有 ,属于非电解质____ 。
(2)除去NaCl中的Na2SO4,依次加入的溶液为(填溶质化学式):______、______、________;
在分液漏斗中加入10 mL 色碘水,然后再注入4 mL CCl4,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是: 操作完毕后,油层(即CCl4层)应从分液漏斗的 口(填“上”或“下”)放出或倒出,为得到碘并回收CCl4可用 法。
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置后,底部白色沉淀,上层为无色溶液;
②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生。
③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)根据以上实验现象可知,该白色固体中一定含有 ,(填化学式,下同)一定不含有 ,可能含有 。
(2)若要检验未确定的物质是否存在,请说明如何操作(包括现象和结论)___________________。
根据题目要求,回答有关问题。
(1)选用下列仪器的编号填空。
①容量瓶 ②分液漏斗 ③蒸馏烧瓶 ④烧杯 ⑤量筒 ⑥托盘天平 ⑦蒸发皿 ⑧试管
可用来加热,且加热时必须垫石棉网的仪器有 ____________ ;
使用时必须检查是否漏水的仪器有_______________;
标有零刻度的仪器有_____________;在仪器上标有使用温度的仪器有___________。
(2) 物质的提纯与分离的方法有:过滤、蒸发结晶、冷却热的饱和溶液的方法结晶(重结晶)、萃取、蒸馏、洗气、升华、高温灼烧等方法。
①从海水中获得淡水应选用 ___________方法,请写出操作的其中两个注意点:
__________________________; _________________________。
②从含有少量氯化钾的硝酸钾溶液中提硝酸钾,应先在_______________下溶解混合物形成浓溶液,再__________________,最后____________可得到硝酸钾晶体。
③除去CO气体中的CO2,可选用__________方法,将混合气体通入____________(填浓NaOH溶液或澄清石灰水)
有关海洋中部分资源的利用如下图所示,回答下列问题

(1)粗盐中除含有泥砂等不溶性杂质外,还含有Ca2+、Mg2+、SO42-等杂质离子。
①除去杂质离子所用试剂按顺序依次是 、 、 (填试剂的化学式),过滤后向滤液中加入适量盐酸,蒸发结晶得精盐。
②检验所得精盐中是否含有SO42-的操作是 。
(2)母液中含有较多的Mg2+,利用流程所示方法可以制取氯化镁溶液,滤渣中加入试剂X的化学方程式为 。
(3)含I-溶液中加入试剂Y的目的是 。
(4)试剂Z可以用_____________,操作Z的名称是 ,所需主要玻璃仪器的名称是 。
选择下列实验方法分离物质,将分离方法的字母填在横线上
A 萃取分液法 B 加热分解法 C 重结晶法
D 分液法 E 蒸馏法 F 过滤法
(1)________分离饱和食盐水和沙子的混合物
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)________分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
(4)________分离水和植物油的混合物
选择下列实验方法分离物质,将正确分离方法的序号填在横线上。
A 萃取 B 升华 C 结晶 D 分液 E 蒸馏 F 过滤
(1)分离饱和食盐水与沙子的混合物__________
(2)提取碘水中的碘单质________
(3)分离水和汽油的混合物________
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物________