某结晶水合物,含有两种阳离子和一种阴离子,其中所含元素均为短周期元素。为确定其组成,有同学进行了如下实验:称取9.06 g样品,溶于水,将溶液分成两等份,待用。
①向一份溶液中逐滴加入6 mol·L-1 NaOH溶液,先观察到有白色沉淀产生,而后产生使湿润的红色石蕊试纸变蓝色的气体,继续滴加NaOH,白色沉淀又逐渐消失,最后得到无色透明溶液。向其中加入足量BaCl2溶液,可得不溶于稀盐酸的白色沉淀4.66 g。
②取另一份溶液,加入足量6 mol·L-1 NaOH溶液,加热,收集到标准状况下的气体224 mL。然后,往溶液中通入足量CO2,过滤,将所得沉淀洗涤、烘干、灼烧,得白色固体0.51 g。
请回答:
(1)该结晶水合物中含有的两种阳离子是 、 ;一种阴离子是 。
(2)试通过计算确定该结晶水合物的化学式,请写出计算过程。
某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水)。有关实验数据如下表:
| |
反应前 |
反应后 |
|
| 实验 数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
| 134.4 g |
10 g |
141.1 g |
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量。
锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下: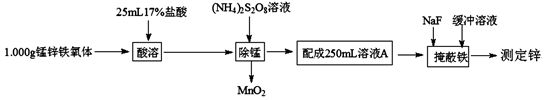
(1)a、b、c的代数关系式为 。
(2)“除锰”时发生反应的离子方程式为 。
(3)配制溶液A用的玻璃仪器有 、烧杯、玻璃棒及胶头滴管。
(4)准确量取25.00 mL溶液A,二甲酚橙作指示剂,用0.01000mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应原理为Zn2++H2Y2-=ZnY2-+2H+),至滴定终点时消耗EDTA 标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数(写出计算过程)。
铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。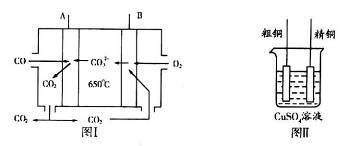
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.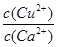 > >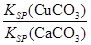 |
D.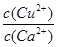 < <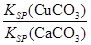 |
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: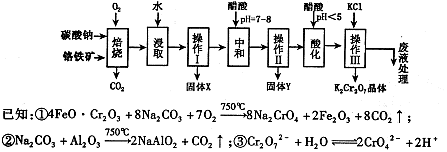
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是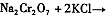
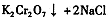 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。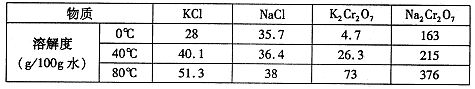
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中会分解。
⑴Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
⑵Ⅱ中,需加一定量酸,该酸最好是 。运用化学平衡原理以及离子方程式简述该酸的作用 。
⑶Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 =2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 |
SO42-、NO3-、Cl- |
| 阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题: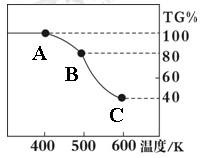
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下: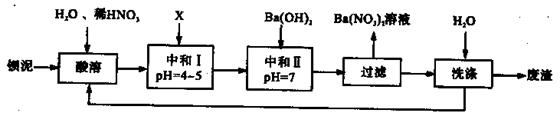
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.lxl0-10, KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________ 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 (填序号);
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)中和I使溶液的pH为4~5目的是 ;
结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
某工厂废液中含有苯酚、乙酸苯酚酌,实验小组对该废液进行探究,设计如下方案: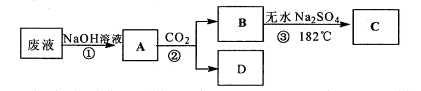
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L-1 NaOH、0.1 mol•L-1 KSCN、酸性KMnO4溶液、FeCl3溶液、饱和浪水、紫色石蕊试液。
| 实验操作 |
预期现象 |
现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 |
|
|
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 |
产生白色沉淀 |
|
| 步骤3:往c试管 |
|
C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入KBrO3浓度为0.01667 moL·L-1的KBrO3+KBr标准溶液30.00mL,酸化并放置。待反应完全后,加入过量的KI,再用0.1100 mol•L-1Na2S2O3标准溶液滴成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。
(部分反应离子方程式:BrO3-+5Br-+6H+=3Br2+3H2O、I2+2S2O32-=2I-+S4O62-)
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| |
密度 (g·mL-1) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
| 苯甲酸 |
1.2659 |
122.13℃ |
249℃ |
微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 |
1.07 |
40.6 |
181.9 |
易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 |
0.79 |
-114.3 °C |
78.5 |
与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下: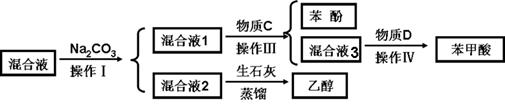
①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
| 实验步骤 |
现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 |
|
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ |
澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 |
_________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
某结晶水合物含有两种阳离子和一种阴离子。称取质量为1.96 g的该结晶水合物,配成溶液。加入足量Ba(OH)2溶液并加热该混合物,生成白色沉淀,随即沉淀变为灰绿色,最后变成红褐色,标况下产生224 mL能使湿润的红色石蕊试纸变蓝的气体;将沉淀过滤、洗涤并灼烧至恒重,得到固体粉末2.73 g;用足量稀盐酸处理上述粉末,洗涤和干燥后得到白色固体2.33 g。
(1)该结晶水合物含有的两种阳离子是__________和__________,阴离子是__________。写出产生能使湿润的红色石蕊试纸变蓝的气体的离子反应方程式: 。
(2)试通过计算确定该结晶水合物的化学式 。
为除去粗盐中的Ca2+、Mg2+、SO42—以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):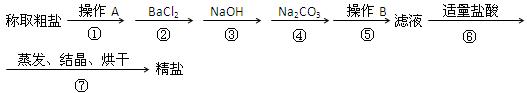
(1)第①步中,操作A是 ,第⑤步中,操作B ;
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
, ;
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
漂白粉常用作消毒剂、杀菌剂、漂白剂等。工业上是把氯气通入含水略少于1 %(质量分数)的消石灰中制得漂白粉。漂白粉是一种混合物,其有效成分是Ca(ClO)2,商品漂白粉中往往含有Ca(OH)2、CaCl2、H2O等杂质。漂白粉质量高低由“有效氯”(过量浓盐酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)和它保持有效氯的时间来决定的。
⑴ 现称取某漂白粉4.00 g配制成500 mL溶液,准确吸取其中25.00 mL后,加入足量的足量浓盐酸和KI溶液,静置。待反应产生的氯气与KI完全反应后,用0.100 mol/L的Na2S2O3溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),到达终点时消耗20.00 mLNa2S2O3溶液。计算该漂白粉中有效氯的百分含量。
⑵ 某研究性学习小组用上述方法测得一种漂白粉的有效氯为56%。请根据推理和计算判断该实验结果是否准确。
⑶ 某品牌漂白粉的组成可表示为Ca(OH)2·3CaCl(OCl)·nH2O,有效氯为35%,n= 。
某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将44.8 L混合气体通入足量溴水,溴水质量增重28.0 g,通过计算回答:
( 1 ) 混合气体中气态烷烃的分子式: _________ 。
( 2 ) 混合气体中两种气体的物质的量之比 _____________ 。
( 3 ) 写出混合气体中气态烯烃可能的结构简式 _________________ 。