[江西]2013届江西省宜春市高三4月模拟考试理综化学试卷
下列说法中不正确的是( )
① 淀粉、纤维素、蔗糖和麦芽糖都能水解,最终水解产物都为葡萄糖。
②将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色。
③ 用新制备的碱性Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖。
④“酸雨”是由大气中的碳、硫、氮的氧化物溶于雨水造成。
⑤ 明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝。
⑥常温常压下,S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA(NA表示阿伏伽德罗常数的值)。
⑦铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起。
| A.①②④⑦ | B.④⑥⑦ | C.①②⑥⑦ | D.③④⑤ |
下列离子方程式表达正确的是( )
| A.向氯化铁溶液中滴加HI溶液:2Fe3++ 2HI = 2Fe2++2H++I2 |
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH—+Al3++2SO42-=2BaSO4↓+AlO +2H2O +2H2O |
| C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+ = Al(OH)3↓+Al3++H2O |
| D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-- |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是:( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项X应为:( )
| 1 |
2 |
3 |
4 |
5 |
6 |
…… |
| CH4 |
C2H6 |
C5H12 |
C8H18 |
…… |
X |
…… |
A. C26H54 B.C20H42 C.C17H36 D.C53H108
某充电电池的原理如下图所示,溶液中c(H+)="2.0" mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色(V 3+)变为紫色(V2+)。下列对此电池叙述正确的是( )
| A.充电时,b极接直流电源正极,a极接直流电源负极 |
| B.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O |
| D.放电时,当转移1.0 mol电子时生成1.0 mol H+,且H+从左槽迁移进右槽 |
将铁粉和铜粉的均匀混合物,平均分成四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编 号 |
① |
② |
③ |
④ |
| 稀硝酸体积/mL |
100 mL |
200 mL |
300 mL |
400 mL |
| 剩余金属/g |
18.0 g |
9.6 g |
0 |
0 |
| NO体积/L |
2.24 L |
4.48 L |
6.72 L |
V |
经化学定量分析,下列推断正确的是( )
A.①中溶解了5.6g Fe B.硝酸的浓度为4mol/L
C.②中溶解了9.6g Cu D.④中V=6.72 L
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族。下图中均含D或F元素的物质均会有图示转化关系: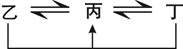
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为 。
(2)F元素在周期表中的位置 ;稳定性:A2C A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 。(忽略混合后溶液的体积变化)。
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 |
SO42-、NO3-、Cl- |
| 阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题: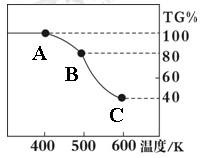
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定;
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(3)步骤④中煮沸的作用是 。
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(5)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(6)若滴定过程中消耗0.4000mol·L−1KI溶液25.00ml,则铁矿石中铁的百分含量为 。
Ⅲ.(7)由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中会分解。
⑴Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
⑵Ⅱ中,需加一定量酸,该酸最好是 。运用化学平衡原理以及离子方程式简述该酸的作用 。
⑶Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 =2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E元素是第四周期元素中未成对电子数最多的元素,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl。F原子的一种核素的质量数为65,中子数为 36。请根据以上情况,回答下列问题:(答题时要用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是 .F元素原子的最外层电子数为 个。
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为 ;B3-离子还可以和一价阴离子互为等电子体,这阴离子电子式为 ,这种阴离子常用于检验日常生活中的一种金属阳离子,这金属阳离子符号为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是 ,ECl3形成的六配位的配合物化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如图,F为 球(“黑”“白”)
3,4,5-三甲氧基苯甲醛(TMB)是一种药物中间体,以对甲基苯酚为原料的合成路线如下:
已知:①A(C7H6OBr2)、B(C7H4OBr4)、C(C7H4O2Br2)、D(C9H9O4Na)均有3种不同化学环境的氢;
②C能发生银镜反应;③同一个碳原子连有2个羟基时,易脱水形成醛基。
④3,4,5-三甲氧基苯甲醛(TMB): 请回答下列问题:
请回答下列问题:
(1)TMB的分子式为 ;A→B的反应类型是 反应。
(2)对甲基苯酚的同分异构体中含有苯环的共有 种.
(3)对甲基苯酚→A的化学方程式为 。
(4)符合下列条件的TMB的同分异构体共有 种,写出这些异构中所有能发生银镜反应的结构简式: 。
①含有苯环和酯基.
②不含过氧键(-O-O-),且不与FeCl3发生显色反应.
③核磁共振氢谱只出现四组峰.





 粤公网安备 44130202000953号
粤公网安备 44130202000953号