下列离子的检验方法正确的是
A.某溶液 有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有Cl- |
B.某溶液 有白色沉淀,说明原溶液中有SO42- 有白色沉淀,说明原溶液中有SO42- |
C.某溶液 无明显变化 无明显变化 溶液变红色,说明原溶液中有Fe2+ 溶液变红色,说明原溶液中有Fe2+ |
D.某溶液 生成无色无味气体,说明原溶液中有CO32- 生成无色无味气体,说明原溶液中有CO32- |
下图所示是分离混合物时常用的仪器,从左至右可以进行的混合物分离操作分别是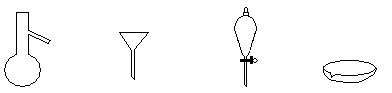
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
下列说法正确的是
| A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- |
| B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- |
| C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ |
| D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂
是
| A.Fe(NO3)3溶液 | B.FeCl2溶液 | C.BaCl2溶液 | D.FeCl3溶液 |
完成下列实验所选择的装置或仪器不正确的是
| |
A |
B |
C |
D |
| 实验 |
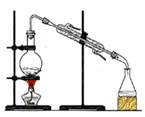
分离水和酒精 |
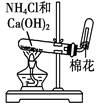
用铵盐和碱制取NH3 |
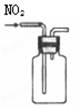
用排空气法收集NO2 |
用自来水制取蒸馏水 |
| 装置 或 仪器 |
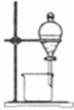 |
 |
 |
 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
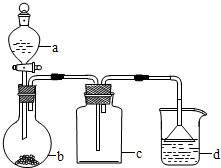
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
饱和食盐水 |
MnO2 |
Cl2 |
NaOH溶液 |
关于海水综合利用问题,下列说法错误的是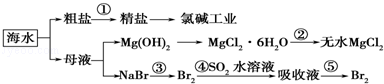
| A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 |
| B.在过程②中若要获得无水MgCl2不可直接蒸干灼烧 |
| C.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| D.第③④步的目的是为了浓缩富集溴 |
为了除去粗盐中的 Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、A12(SO4)3、CuSO4五种溶液,这种试剂是
| A.氨水 | B.NaOH溶液 | C.硫酸 | D.NaNO3溶液 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到.若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
下列关于化学实验基本操作的叙述中,正确的是
| A.加热蒸发时,蒸发皿必须垫石棉网 |
| B.制Fe(OH)3胶体时,将饱和FeCl3溶液加热煮沸 |
| C.分液时,放出分液漏斗下层液体后,再继续放出上层液体 |
| D.蒸馏时,在烧瓶中加入沸石或碎瓷片,以防止液体暴沸 |