对于某些离子的检验及结论一定正确的是( )
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法错误的是( )
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
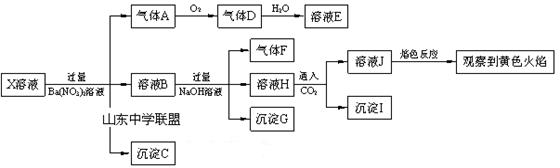
下列结论正确的是( )
| A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- |
| B.气体F在氧气中经催化氧化可生成气体A |
| C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3 |
| D.X中不能确定的离子是Fe2+、SO32-、K+和C1- |
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
| A.原溶液中一定含有Br-、SO42- |
| B.原溶液一定含有Na+,不含Ba2+ |
| C.实验①与上述离子的检验无关,可以省略 |
| D.若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
下列装置所示的分离提纯方法和物质的溶解性无关的是
A.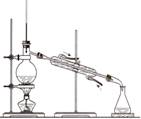 |
B.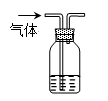 |
C.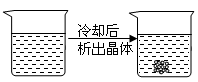 |
D. |
现有三组溶液:①煤油和氯化钾溶液 ②35%的乙醇溶液 ③碘单质和氯化钠固体,分离以上各混合体系最合适的方法依次是( )
| A.分液、蒸馏、萃取 | B.萃取、蒸馏、升华 |
| C.分液、蒸馏、升华 | D.蒸馏、分液、萃取 |
有NaCl、KSCN、NaOH、AgNO3、四种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
| A.盐酸 | B.Na2CO3溶液 | C.氯水 | D.FeCl3溶液 |
溶液X中含有右表离子中的某5种,且其浓度均为 0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是
| 阳离子 |
阴离子 |
| Na+Ca2+ Fe2+Al3+ Fe3+ Mg2+ |
OH- HCO3-CO32-Cl-NO3- SO42- |
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。根据上述实验事实推断,在该溶液中肯定存在的离子组是( )
| A.Na+、Br-、CO32- | B.Na+、 I-、SO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、Br-、CO32- |
根据下列化学实验事实得出的结论一定正确的是( )
| A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。结论:该溶液中含有SO42- |
| B.向某无色溶液中加入足量盐酸,产生能使澄清石灰水变浑浊的气体。结论:该溶液中含有CO32—或HCO3— |
| C.向1 mL浓度均为0.05 mol/L的NaCl、NaI混合溶液中滴加2滴0.01 mol /L的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI) |
| D.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。结论:该溶液中有NH4+ |
下列提纯方法不正确的是
| A.除去硝酸钾中的氯化钠-----结晶 |
| B.除去食盐水中的泥沙----过滤 |
| C.除去氯化钾溶液中的碳酸钾-----加适量盐酸 |
| D.除去水中的碘单质---升华 |