(1)用l体积SO2和3体积氧气混合,在450℃以上通过V2O5催化剂,发生如下反应: 一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为_________%,
一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为_________%,
(2)在25℃时,有pH=m(m≤6)的盐酸 L和pH="n" (n>8)的NaOH溶液
L和pH="n" (n>8)的NaOH溶液 L。二者混合恰好完全中和。问:若n+m=13时,则
L。二者混合恰好完全中和。问:若n+m=13时,则 /
/ =___________.
=___________.
(3)利用下图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于____处。
若X为锌,开关K置于M处,该电化学防护法称为 。
(10分)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
|
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。

(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,补全实验步骤和结论。
实验步骤和结论
①药品用量和操作同编号①实验(多孔橡皮塞增加进、
出导管);
②通入氩气排净瓶内空气;
③ 。
有关中学常见元素X、Y、Z、D、E的信息如下:
| 元素 |
有关信息 |
| X |
元素主要化合价为-2 |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
与X同主族,其单质在X的单质中燃烧,发出蓝紫色火焰 |
| D |
最高价氧化物既能溶于强酸又能溶于强碱 |
| E |
单质是生活中常见金属,其制品在潮湿的空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)X在元素周期表中的位置 ;画出Y的离子结构示意图 ;
(2)Y、Z的最高价氧化物对应的水化物酸性较强的是(填化学式) ;
X、Y、D形成的简单离子的半径由大到小为(填离子符号) 。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 ,D的最高价氧化物溶于强碱的离子方程式 。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)E单质在潮湿空气中被腐蚀的正极反应式为 。
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
分析图像,以下结论错误的是
| A.析氢腐蚀和吸氧腐蚀的速率一样快 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.溶液pH≤2时,生铁发生析氢腐蚀 |
| D.两溶液中负极反应均为:Fe – 2e===Fe2+ |
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表中②的实验目的:
| 编号 |
实验目的 |
碳粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
|
0.5 |
2.0 |
36.0 |
| ③ |
碳粉质量的影响 |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀;此时,碳粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是: 。
(3)该小组对图中0~t1时压强变大的原因提出如下假设。
请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤及结论: 。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为。
②图中四个区域,生成铁锈最多的是(填字母)。
(2)用废铁皮制取铁红()的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为。
②步骤Ⅱ中发生反应:,反应产生的
又将废铁皮中的铁转化为
,该反应的化学方程式为。
③上述生产流程中,能体现"绿色化学"思想的是(任写一项)。
(3)已知t℃时,反应的平衡常数
=0.25。
①t℃时,反应达到平衡时=。
②若在1 密闭容器中加入0.02
,并通入
,t℃时反应达到平衡。此时
转化率为50%,则
=。
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:
20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是 。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为__________________。
(2)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_________________。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________________。
(3)镀铜可防止铁制品腐蚀,电镀时阳极材料为________________,用铜而不用石墨作阳极的原因是______________________。
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论正确的是( )
| A.溶液pH ≤ 2时,生铁发生吸氧腐蚀 |
| B.在酸性溶液中生铁只能发生析氢腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为Fe – 2e-=Fe2+ |
金属锌为活泼金属,易被腐蚀。下列关于锌的腐蚀说法正确的是( )




| A.图a中,插入海水中的锌棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化作用引起的 |
下列叙述中, 正确的是
①纯铁比碳素钢易生锈
②大量燃烧含硫燃料是形成酸雨的主要原因
③硅是光导纤维和制造太阳能电池的主要原料
④可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C>Si
⑤氯水和过氧化钠都具有漂白作用,其漂白原理相似
⑥用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
⑦日本福岛核电站泄露的放射性核素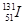 和
和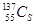 ,前者比后者少8个中子
,前者比后者少8个中子
⑧Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝金属
| A.①⑤⑥⑦ | B.②③⑤⑦ | C.③④⑤⑥ | D.②⑤⑥⑧ |
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0 kJ·mol-1
C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的 △H= kJ·mol-1。
(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色(b),如图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(3)铁钛合金是一种不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。