下列叙述不正确的是
| A.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其生腐蚀 |
| B.反应SO2(g)+2H2S(g)=3S(S)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
| C.0.1mol·L-1的CH3COOH溶液加水稀释,溶液的pH和溶液中水的电离程度均增大 |
| D.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,存在KW/c(H+)>1.0×10-7 mol·L-1 |
某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________.
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为________.
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________.
(4)丙组同学取10mL 0.1mol•L﹣1KI溶液,加入6mL 0.1mol•L﹣1 FeCl3溶液混合.分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红.
实验②检验的离子是________(填离子符号);实验①和③说明:在I﹣过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________.
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是________,生成沉淀的原因是________(用平衡移动原理解释).
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度 |
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.加入脱氧剂的目的是因为该反应是吸热过程,可降低温度,延长食品保质期 |
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
取6根铁钉,6支干净的试管及其他材料,如图所示。
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____ (填试管序号);在电化学腐蚀中,负极反应是__________。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是___________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______(答两种方法)。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为__________________。
(2)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_________________。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________________。
(3)镀铜可防止铁制品腐蚀,电镀时阳极材料为________________,用铜而不用石墨作阳极的原因是______________________。
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论正确的是( )
| A.溶液pH ≤ 2时,生铁发生吸氧腐蚀 |
| B.在酸性溶液中生铁只能发生析氢腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为Fe – 2e-=Fe2+ |
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:
20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是 。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn—MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
在日常生活中,我们经常看到铁制品生镑、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
| A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图I所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl-—2e-—Cl2↑ |
| D.图Ⅲ装置的总反应为4A1+302+6H20——4A1(0H)3,生成的Al(OH)3进一步脱水形成白斑 |
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤II中发生反应:4Fe(NO3) 2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
(1)某兴趣小组利用如图所示装置进行实验。
闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;在A注射器收集到的气体是 ,阳极电极反应式为 。当电路中转移0.001mol电子时,B注射器最多可以收集到气体 mL(折算为标准状况)。
(2)某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究。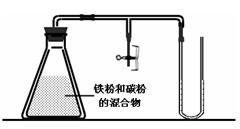
①首先向锥形瓶内加入铁粉和碳粉的混合物、氯化钠溶液,半分钟后发现U型管内左侧液面高过右侧液面,这现象说明,在中性条件下发生 腐蚀,请写出该反应的电极反应方程式
负极: 正极:
②清洗锥形瓶后,重新加入铁粉和碳粉的混合物,加入1mol/L醋酸溶液,半分钟后发现U型管内左侧液面高过右侧液面,这一现象说明,前半分钟 腐蚀占优势,请写出这时正极主要的电极反应方程式 ,5分钟后发现U型管内右侧液面高过左侧液面,此时 腐蚀占据优势,请写出此时正极的电极反应方程式 。