某化学研究性学习小组的同学在学习了电化学相关知识后,将所学知识整合得到如图所示装置,用于电解饱和食盐水。
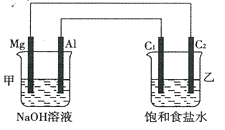
请回答下列问题:
(1)甲池中Al极为 极,乙池中C2极为 极;
(2)甲池中发生反应的总化学方程式为 ;
(3)若向乙池中滴加酚酞试液,则C1极附近观察到的现象为 ,C2极的电极反应式为 ;
(4)当C1极析出224mL气体(标准状况)时,转移电子的物质的量为 。
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
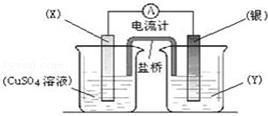
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极发生的电极反应为 ;
(3)X电极上发生的电极反应为 ;
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32—(aq) PbCO3(s)+SO42—(aq)。
PbCO3(s)+SO42—(aq)。
Ksp (PbCO3)=1.5×10-13,Ksp (PbSO4)=1.8×10-8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)计算上述反应的平衡常数:K= 。
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式____________
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,
假设一:全部为2PbCO3·Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3·Pb(OH)2和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究。
| 实验步骤 |
实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶。 |
无水硫酸铜变蓝色,澄清石灰水变浑浊 说明样品全部是2PbCO3·Pb(OH)2 |
①你是否同意该同学的结论,并简述理由 。
②如果不同意,请提出改进意见___________________________
由铜、锌和稀硫酸组成的原电池中:
(1)锌是 极,电极反应式是 。
(2)铜是 极,电极反应式是 。
(3)在铜极上可以观察到有 (填实验现象)
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(12分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol。
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式:____________________。该电池总反应式:________________________。
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到0.32 g O2,中和电解生成的酸需0.4 mol·L-1 NaOH溶液 mL。
氯铝电池是一种新型的燃料电池,电解质溶液是KOH溶液。试回答下列问题:
(1)通入氯气的电极是__________极(填“正”或“负”);
(2)铝电极是__________极(填“正”或“负”);
(3)电子从__________(填“Al”或“Cl2”,下同)电极流向__________的电极。
(共13分)由铜、锌和稀硫酸组成的原电池中: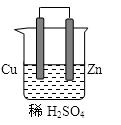
(1)锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)下列装置能够组成原电池是( )
普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是_____________________________________为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的离子方程式为__________。
(2)为了保护这些纸质文物,有人建议采取如下措施:喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷,生成的氧化锌可以防止酸性腐蚀。用该方法生成氧化锌的化学方程式为__________________。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾。钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
① FeTiO3+ C+ Cl2  TiCl4+ FeCl3+ CO
TiCl4+ FeCl3+ CO
② TiCl4+O2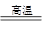 TiO2+2Cl2
TiO2+2Cl2
(4)某新型“纸电池”以碳纳米管和金属锂为两极,造纸用的纤维素在一种离子液体M中溶解作隔离膜,电池工作时的总反应式为xLi+C(碳纳米管) LixC,下列有关说法正确的是
LixC,下列有关说法正确的是
| A.放电时Li+由正极向负极移动 |
| B.充电池的阳极反应式为LixC-xe-= xLi++ C |
| C.M可能为羧酸、醇等含活泼氢的有机物 |
| D.锂离子电池的比能量(单位质量释放的能量)低 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。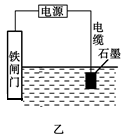
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。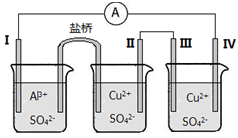
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是______________________。
(2)工作时,正极反应为______________________。
(3)工作时,电解质溶液的酸性________(填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向________极。(填“正”或者“负”)
(5)电流方向从________极流向________极。(填“正”或者“负”)